题目内容
9.铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )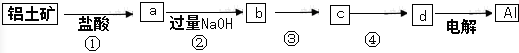
| A. | ①、②、③中除加试剂外,还需要进行过滤操作 | |
| B. | a、b中铝元素的化合价相同 | |
| C. | ③中需要通入过量的氨气 | |
| D. | ④进行的操作是加热,而且d一定是氧化铝 |
分析 铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,铝土矿加盐酸生成Al3+和Fe3+,二氧化硅不溶于盐酸,所以要过滤,分离出二氧化硅;滤液a中加过量NaOH,Al3+转化为AlO2-、Fe3+转化为Fe(OH)3沉淀,过滤除去Fe(OH)3沉淀,向滤液b中通过量的二氧化碳,会生成c为Al(OH)3沉淀,Al(OH)3分解生成d为Al2O3,最后电解熔融的Al2O3生成Al.
解答 解:铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,铝土矿加盐酸生成Al3+和Fe3+,二氧化硅不溶于盐酸,所以要过滤,分离出二氧化硅;滤液a中加过量NaOH,Al3+转化为AlO2-、Fe3+转化为Fe(OH)3沉淀,过滤除去Fe(OH)3沉淀,向滤液b中通过量的二氧化碳,会生成c为Al(OH)3沉淀,Al(OH)3分解生成d为Al2O3,最后电解熔融的Al2O3生成Al,
A、由以上分析可知①、②、③中除加试剂外,都需要对固体和溶液分离,所以还需要进行过滤操作,故A正确;
B、a中为Al3+,b中为AlO2-,a、b中铝元素的化合价均为+3价,故B正确;
C、③中需要把AlO2-转化为Al(OH)3沉淀,要通入过量的二氧化碳,AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,偏铝酸钠和氨气不反应,故C错误;
D、根据上面分析可知④是Al(OH)3受热分解生成Al2O3,故D正确.
故选C.
点评 本题考查了铝土矿中提取Al的工艺流程,注意除杂试剂的选择和物质的分离方法,同时涉及了铝的化合物的性质,题目难度中等.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
1. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )
 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )| A. | 当电路中通过4mol电子的电量时,生成有标准状况下的O2为22.4L | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 正极区反应为2H2O-4e-═O2+4H+,正极区溶液pH降低 | |
| D. | 通电后中间隔室的SO42-离子向负极区迁移,负极区溶液pH增大 |
17.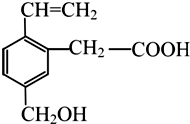 某有机物的结构如图所示,这种有机物具有的性质是( )
某有机物的结构如图所示,这种有机物具有的性质是( )
①可以与氢气发生加成反应;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应.
 某有机物的结构如图所示,这种有机物具有的性质是( )
某有机物的结构如图所示,这种有机物具有的性质是( )①可以与氢气发生加成反应;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应.
| A. | 只有①④ | B. | 只有①④⑤ | C. | ①②③④ | D. | 全部 |
4.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| B. | 检测时,电解质溶液中的 H+向负极移动 | |
| C. | 若有 0.4 mol 电子转移,则在标准状况下消耗 4.48 L 氧气 | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
14.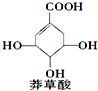 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有2种官能团 | |
| B. | 在水溶液中羧基和羟基均能电离出H+ | |
| C. | 分子式为C7H6O5 | |
| D. | 可发生加成和取代反应 |
18.下列颜色变化与氧化还原反应无关的是( )
| A. | 将乙醛加入新制氢氧化铜中加热,出现砖红色沉淀 | |
| B. | 将乙醇滴入酸性重铬酸钾溶液中,溶液由橙色变为绿色 | |
| C. | 将二氧化硫通入滴有酚酞的氢氧化钠溶液中,溶液红色褪去 | |
| D. | 新制氯水敞口久置,颜色褪去 |
19.下列叙述中错误的是( )
| A. | 还原性:Na>Mg>Al>Fe | B. | 碱性:NaOH>KOH>Ca(OH)2 | ||
| C. | 稳定性:HF>HCl>HBr>HI | D. | 酸性:HClO4>H2SO4>CH3COOH>H2CO3 |
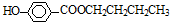 )可用作防腐剂,对酵母菌和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
)可用作防腐剂,对酵母菌和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线: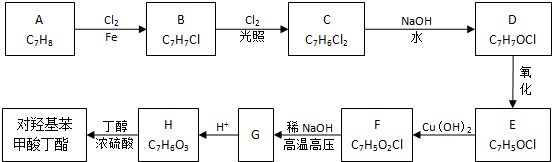
 +2Cu(OH)2 $\stackrel{△}{→}$
+2Cu(OH)2 $\stackrel{△}{→}$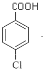 +Cu2O↓+2H2O;
+Cu2O↓+2H2O;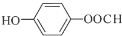 ,其核磁共振氢谱中不同化学环境的氢的峰面积比为1:2:2:1,它与足量NaOH溶液反应的方程式为
,其核磁共振氢谱中不同化学环境的氢的峰面积比为1:2:2:1,它与足量NaOH溶液反应的方程式为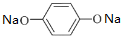 +HCOONa+2H2O.
+HCOONa+2H2O.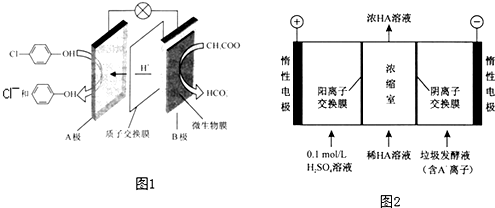
 )的废水可以通过构成微生物电池除去,其原理如图1所示.
)的废水可以通过构成微生物电池除去,其原理如图1所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.