题目内容
1.五种短周期元素A、B、C、D、E的原子序数依次增大.A、C同主族,B、D同主族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.请回答下列问题:(1)五种元素中,原子半径最大的是Na(写元素符号),D在元素周期表中的位置为第三周期第ⅤA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物热稳定性最差的是PH3(写化学式).
(3)由上述元素组成的物质,含有A的二元离子化合物的电子式为Na+[:H]-;A和E形成的化合物与A和B形成的化合物反应,产物的化学式为NH4Cl,其中存在的化学键类型为离子键和共价键.
(4)单质C与硫酸铜溶液反应的离子方程式为:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑.
(5)写出一种工业制备单质E的化学方程式:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑.
分析 五种短周期元素A、B、C、D、E的原子序数依次增大.A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为氢元素、B为氮元素;A和C同族,C的原子序数大于氮元素,故C为Na元素;B和D 同族,则D为磷元素;C和E形成的化合物在水中呈中性,则E为Cl元素,验证符合,据此解答.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大.A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为氢元素、B为氮元素;A和C同族,C的原子序数大于氮元素,故C为Na元素;B和D 同族,则D为磷元素;C和E形成的化合物在水中呈中性,则E为Cl元素,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故Na元素的原子半径最大;D为磷元素是第三周期第ⅤA族元素,故答案为:Na;第三周期第ⅤA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是非金属性最强的氯对应的HClO4 ;非金属气态氢化物热稳定性最差的是非金属性最弱的磷,形成的磷化氢,故答案为:HClO4;PH3;
(3)这几种元素只有Na能与H形成离子化合物,则a的化学式为NaH电子式为:Na+[:H]-;A和E形成的化合物该化合物为HCl,与A和B形成的化合物该化合物为NH3反应,产物的化学式为氯化铵,化学式为:NH4Cl,既含离子键又含共价键,故答案为:Na+[:H]-;NH4Cl;离子键和共价键;
(4)钠先和水反应为氧化还原反应,氧化剂H2O,被氧化的元素Na,氧化产物NaOH,生成NaOH和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,离子反应为2Na+2H2O═2Na++2OH-+H2↑,NaOH与硫酸铜发生复分解反应,反应的化学方程式为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,生成氢氧化铜和硫酸钠,离子反应为Cu2++2OH-=Cu(OH)2↓,总反应为:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑,
故答案为:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑;
(5)电解质熔融氯化钠生成钠和氯气,化学方程式:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑,故答案为:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑.
点评 本题考查位置结构性质关系、常用化学用语、元素周期律、化学键等,难度中等,推断元素是解题的关键,注意对基础知识的理解掌握.

 新非凡教辅冲刺100分系列答案
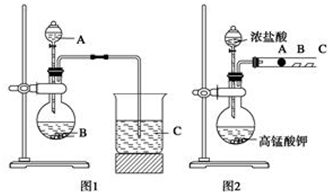
新非凡教辅冲刺100分系列答案| A. | 蒸馏实验时向蒸馏烧瓶中放入几粒沸石(或碎瓷片) | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 用试管加热碳酸氢钠固体时使试管口略向上倾斜 | |
| D. | 浓硫酸溅到皮肤上立即用稀氢氧化钠溶液冲洗 |
| A. | 能使石蕊溶液呈红色的溶液中:Na+、SO42-、Fe3+、MnO4-可以大量共存 | |
| B. | NA代表阿伏加德罗常数的数值,1 mol硫酸氢钾晶体中阳离子所带电荷总数为NA | |
| C. | 235U与238U的相互转化不是化学变化 | |
| D. | 元素O、S、P的气态氢化物热稳定性依次增强 |
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |

已知K2MnO4溶液显绿色,KMnO4溶液紫红色.请回答下列问题:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.醋酸 C.盐酸 D.硫酸
(3)下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(4)当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(5)烘干时,温度控制在80℃为宜,温度不宜过高的理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(6)通过用草酸滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①滴定过程溶液中发生的离子反应为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有100ml容量瓶、胶头滴管.
③量取KMnO4待测液10.00ml,若该滴定管用蒸馏水洗净后未润洗,则测定结果将偏小.
④滴定终点溶液的颜色变化是溶液由红色变无色.
⑤经测定每滴定10.00ml待测液平均消耗c mol/L草酸标准液Vml,样品纯度的表达式为$\frac{CVM}{250W}$×100%(高锰酸钾摩尔质量用M表示).
| A. | 己烯、苯、苯酚 | B. | 乙醛、乙酸、乙醇 | C. | 乙酸、乙醇、苯酚 | D. | 乙烷、乙烯、乙炔 |
 A、B、C、D、E五种元素的原子序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列同题.
A、B、C、D、E五种元素的原子序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列同题.
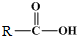 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$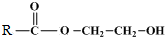
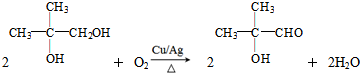 .
. .
.