题目内容
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、由强酸与强碱等物质的量反应得到的溶液 |
| C、使酚酞试液呈无色的溶液 |
| D、c(H+)=c(OH-)=10-6mol/L的溶液 |
考点:溶液pH的定义
专题:电离平衡与溶液的pH专题
分析:溶液酸碱性是由溶液中的氢离子浓度和氢氧根离子浓度相对大小决定,c(H+)>c(OH-)溶液呈酸性;c(H+)<c(OH-)溶液呈碱性;c(H+)=c(OH-)溶液呈中性,据此进行判断.
解答:
解:A.pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10-12,pH=6时溶液呈中性,当pH=7时溶液呈碱性,故A错误;
B.由强酸与强碱等物质的量反应得到的溶液,若氢离子浓度物质的量与氢氧根离子的物质的量不相等,反应后溶液不会显示中性,故B错误;
C.酚酞的变色范围是8-10,酚酞显示无色,溶液有可能显示碱,故C错误;
D.c(H+)=c(OH-)=10-6mol/L溶液,氢离子浓度与氢氧根离子浓度相等,溶液一定呈中性,故D正确.
故选D.
B.由强酸与强碱等物质的量反应得到的溶液,若氢离子浓度物质的量与氢氧根离子的物质的量不相等,反应后溶液不会显示中性,故B错误;
C.酚酞的变色范围是8-10,酚酞显示无色,溶液有可能显示碱,故C错误;
D.c(H+)=c(OH-)=10-6mol/L溶液,氢离子浓度与氢氧根离子浓度相等,溶液一定呈中性,故D正确.
故选D.
点评:本题考查了溶液酸碱性的判断,明确溶液的酸碱性取决于溶液中c(OH+)、c(H+)的相对大小是解本题的关键,很多同学仅仅根据pH大小判断而导致错误判断,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | ||
| B、0.1mol/LH2SO4与0.1mol/L氨水等体积混合:c(H+)>c(NH4+)>c(SO42-)>c(OH-) | ||
C、0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:
| ||
| D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
家用消毒液的发生器是以精盐和自来水为反应物,通电时,发生器的电解槽的极板上产生大量气泡,切断电源后,生成液具有强烈的杀菌消毒能力.与该反应器工作原理直接有关的化学方程式是( )
| A、2NaOH+Cl2═NaCl+NaClO+H2O |
| B、H2+Cl2═2HCl |
| C、2NaCl(熔融)=2Na+Cl2↑ |
| D、2HClO═2HCl+O2↑ |
 在密闭容器中进行下列反应:M(g)+N(g)═R(g)+2L.此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )
在密闭容器中进行下列反应:M(g)+N(g)═R(g)+2L.此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )| A、正反应为吸热反应 L是气体 |
| B、正反应为放热反应 L是气体 |
| C、正反应为吸热反应 L是固体 |
| D、正反应为放热反应 L是固体或液体 |
将BaO2放入密闭真空容器中,反应BaO2(s)?BaO(s)+
O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| 1 |
| 2 |
| A、氧气压强不变 | ||||
| B、BaO质量增加 | ||||
| C、BaO2质量不变 | ||||
D、平衡常数K=
|
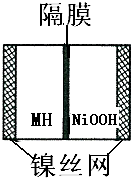 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、电池的电解液可为稀H2SO4溶液 |
| C、充电时负极反应为:MH+OH--e-═H2O+M |
| D、MH是一类储氢材料,其所含氢密度越大,电池的能量密度越高 |