题目内容
16.过氧化氢(H2O2)的水溶液俗称双氧水.双氧水常被称为化学反应中的“绿色试剂”.已知,在含少量I-的溶液中,H2O2会较快分解,反应如下:反应①:H2O2+I-→H2O+IO-;
反应②:H2O2+IO-→H2O+O2+I-
完成下列填空:
(1)反应①中的氧化产物是IO-,被还原的元素是负一价的O.
(2)标出反应②中电子转移的方向和数目.
(3)H2O2分解过程中,I-的作用是催化剂.
(4)根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是H2O2的氧化产物是O2,还原产物是H2O,都不会污染环境.
(5)H2O2是一种二元弱酸,写出第一步电离的电离方程式:H2O2?H++HO2-,双氧水可漂白纤维织物,目前认为是其中过氧化氢离子(HOO-)的作用.为了增强其漂白效果,应选择在碱(填“酸”、“碱”或“中”)性条件下进行.
(6)向盐酸酸化的FeCl2溶液中加入双氧水,溶液由浅绿色变为棕黄色,写出该变化的化学反应方程式:2FeCl2+H2O2+2HCl=2FeCl3+2H2O.
分析 (1)分析反应中元素化合价变化,结合氧化还原反应基本概念判断;
(2)H2O2+IO-→H2O+O2+I-,反应中过氧化氢中-1价氧化合价升高为氧气中0价,IO-中+1价碘得到电子化合价降为-1价,消耗1mol过氧化氢转移2mol电子,结合单线桥表示电子转移的方向和数目;
(3)依据反应反应①:H2O2+I-→H2O+IO-; 反应②:H2O2+IO-→H2O+O2+I-,结合催化剂在反应前后质量和性质不变解答;
(4)依据过氧化氢氧化产物、还原产物都是水解答;
(5)过氧化氢为二元弱酸,第一步电离产生氢离子H+和HO2-,注意弱电解质电离应可逆号;依据化学平衡移动原理解答;
(6)过氧化氢具有强的氧化性,能够氧化二价铁离子生成棕黄色的三价铁离子,结合氧化还原得失电子守恒、原子个数守恒书写方程式.
解答 解:(1)反应H2O2+I-→H2O+IO-,过氧化氢中-1价的O化合价降低,被还原,-1价的碘化合价升高为:IO-中+1价,被氧化,对应氧化产物;
故答案为:IO-;负一价的O;
(2)H2O2+IO-→H2O+O2+I-,反应中过氧化氢中-1价氧化合价升高为氧气中0价,IO-中+1价碘得到电子化合价降为-1价,消耗1mol过氧化氢转移2mol电子,电子转移的方向和数目用单线桥表示为: ;
;
故答案为: ;
;
(3)依据反应反应①:H2O2+I-→H2O+IO-; 反应②:H2O2+IO-→H2O+O2+I-,I-在反应前后质量和性质都不变,所以碘离子为反应的催化剂;
故答案为:催化剂;
(4)根据反应①和反应②可知,H2O2的氧化产物是O2,还原产物是H2O,都不会污染环境,所以被称为“绿色试剂”;
故答案为:H2O2的氧化产物是O2,还原产物是H2O,都不会污染环境;
(5)过氧化氢为二元弱酸,第一步电离产生氢离子H+和HO2-,电离方程式:H2O2?H++HO2-;依据H2O2?H++HO2-可知,碱性环境下可以促进过氧化氢电离,生成过氧化氢离子离子浓度增大,所以为增强其漂白效果,应选择碱性环境;
故答案为:H2O2?H++HO2-;碱;
(6)过氧化氢具有强的氧化性,能够氧化二价铁离子生成棕黄色的三价铁离子,反应的化学方程式:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;
故答案为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O.
点评 本题考查了过氧化氢性质,涉及氧化还原反应基本概念判断、弱电解质电离方程式书写、氧化还原反应方程式书写,明确过氧化氢性质是解题关键,题目难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案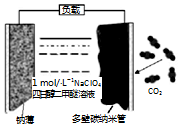 可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )
可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )| A. | 放电时,Na+向正极移动 | |
| B. | 放电时,电子从钠薄经负载流向多壁纳米碳管 | |
| C. | 充电时,钠薄和外接电源的负极相连,发生氧化反应 | |
| D. | 充电时,阳极的电极反应为:2Na2CO3+C-4e-═4Na++3CO2↑ |
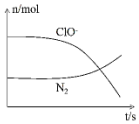 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )| A. | 该反应中Cl-为氧化产物 | B. | 消耗1 mol还原剂,转移6 mol电子 | ||
| C. | 反应后溶液的酸性减弱 | D. | NH4+被ClO-氧化成N2 |
| 选项 | 实验目的 | 实验操作 |
| A | 除去NH4Cl溶液中的Fe3+ | 加入氨水至不再产生沉淀为止,然后过滤 |
| B | 检验某溶液中是否存在SO32- | 取少量溶液于试管中,滴加盐酸酸化的硝酸钡 |
| C | 证明Mg的金属性强于Al | 分別向MgCl2、AlCl3的溶液中加人足量的氨水 |
| D | 配制 100 mL0.lmol•L-1H2SO4溶液 | 用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
| 实验目的 | 实验步骤和装置 | |
| A | 探究温度对反应速率的影响 | 不同温度下,分别取同体积0.1mol•L-1KI溶液,向其中匀先加入淀粉溶液3滴,再各加入0.1mol•L-1硫酸5滴,并同时记录溶液出现蓝色的时间 |
| B | 配制100mL1.0mol•L-1NaOH溶液 | 向100mL容量瓶中加入4.0gNaOH固体,加水到刻度线 |
| C | 验证牺牲阳极的阴极保护法 | 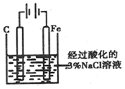 往铁电极附近滴加铁氯化钾溶液 |
| D | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 向醋酸溶液中加水,醋酸的电离程度增大,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$增大 | |
| C. | 向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若NaHA溶液中的pH>7,则H2A是弱酸;若NaHA溶液中的pH<7,则H2A是强酸 |
| A. | 乙醇、乙酸均能与NaOH溶液反应 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | C4H8Cl2有9种同分异构体 |
| A. | 食醋 | B. | 料酒 | C. | 食盐 | D. | 麻油 |
