题目内容
3.足量下列物质能与等质量的氧化铝反应,且消耗溶质物质的量最少的是( )| A. | 氢氧化钠溶液 | B. | 稀硫酸 | C. | 稀盐酸 | D. | 氨水 |
分析 NaOH、硫酸、HCl分别与氧化铝反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Al2O3+6HCl=2AlCl3+3H2O,氨水和氧化铝不反应,据此分析解答.
解答 解:氨水和氧化铝不反应,NaOH、硫酸、HCl分别与氧化铝反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Al2O3+6HCl=2AlCl3+3H2O,根据方程式知,消耗相同的氧化铝时消耗NaOH的物质的量最少,故选A.
点评 本题考查化学方程式有关计算,为高频考点,正确书写方程式是解本题关键,注意氧化铝的两性,但氧化铝不溶于弱碱溶液,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热 量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在10l k Pa时l mol H2完全燃烧生成液态水放出285.8 kJ热量,H2燃烧热为-285.8KJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+oH-(aq)=H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
14.下列溶液中粒子数目由多到少的顺序正确的是( )
①20mL0.01mol•L-1KCl溶液 ②30mL0.02mol•L-1CaCl2溶液
③10mL0.03mol•L-1HCl溶液 ④40mL0.01mol•L-1MgCl2溶液
⑤50mL0.05mol•L-1AgNO3溶液.
①20mL0.01mol•L-1KCl溶液 ②30mL0.02mol•L-1CaCl2溶液
③10mL0.03mol•L-1HCl溶液 ④40mL0.01mol•L-1MgCl2溶液
⑤50mL0.05mol•L-1AgNO3溶液.
| A. | ⑤>②>④>③>① | B. | ④>①>③>②>⑤ | C. | ⑤>④>②>①>③ | D. | ④>③>⑤>②>① |
11.禁止用工业酒精配置饮料,是因为工业酒精中含有某种毒性很强的醇,该醇是( )
| A. | 甲醇 | B. | 乙二醇 | C. | 丙三醇 | D. | 异戊醇 |
18.下列性质不属于金属共性的是( )
| A. | 电热的良导体 | B. | 金属阳离子的氧化性 | ||
| C. | 单质的还原性 | D. | 高沸点 |
8.已知在常温下测得浓度均为0.1mol•L-1的四种溶液的pH如表:
(1)根据盐溶液的pH,可知①Ka(HClO)②Ka2(H2CO3)③Ka2(H2CO3)④Ka(HF)由大到小的顺序为④②①③(填序号)
(2)将CO2通入0.1mol•L-1的Na2CO3溶液中,至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1(忽略溶液体积变化)
(3)常温下,向0.1mol•L-1的HF溶液加水稀释的过程中,下列表达式的值变大的是C
A.c(H+) B.c(H+•c(OH-) C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$
(4)向84消毒液中通入少量的CO2,发生反应的化学方程式为NaClO+CO2+H2O═HClO+NaHCO3
(5)已知Ksp(CaF2)=1.5×10-10,将0.1mol•L-1的NaF溶液和0.1mol•L-1的CaCl2溶液等体积混合,则下列说法正确的是①(填序号)
①两溶液混合后有CaF2沉淀生成
②升高混合溶液的温度,Ksp(CaF2)不变
③溶液中一定存在c(F-)=c(Ca2+)
④向溶液中加入Ca(NO3)2固体,CaF2的溶解度不变.
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | .6 | 7.5 | 9.7 |
(2)将CO2通入0.1mol•L-1的Na2CO3溶液中,至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1(忽略溶液体积变化)
(3)常温下,向0.1mol•L-1的HF溶液加水稀释的过程中,下列表达式的值变大的是C
A.c(H+) B.c(H+•c(OH-) C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$
(4)向84消毒液中通入少量的CO2,发生反应的化学方程式为NaClO+CO2+H2O═HClO+NaHCO3
(5)已知Ksp(CaF2)=1.5×10-10,将0.1mol•L-1的NaF溶液和0.1mol•L-1的CaCl2溶液等体积混合,则下列说法正确的是①(填序号)
①两溶液混合后有CaF2沉淀生成
②升高混合溶液的温度,Ksp(CaF2)不变
③溶液中一定存在c(F-)=c(Ca2+)
④向溶液中加入Ca(NO3)2固体,CaF2的溶解度不变.

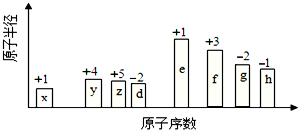 随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.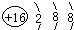 .
.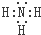 .
.