题目内容
10.如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,
则:(1该浓硫酸的物质的量浓度为18.4mol/L,需要该浓硫酸的体积为62.5mL;
(2)可供选用的仪器有:胶头滴管;烧瓶;烧杯;药匙;量筒;托盘天平.配制稀硫酸时,还缺少的仪器有玻璃棒、250mL的容量瓶.
(3)配置过程中有几个关键的步骤和操作如图2所示:将下列实验步骤A-F按实验过程先后次序排列CBDFAE.
(4)该同学实际配置得到的浓度为4.5mol/L,可能的原因是AD.
A、量取浓H2SO4时俯视刻度
B、容量瓶洗净后未经干燥处理
C、将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D、定容时仰视刻度线.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;依据稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;
(2)根据配制一定物质的量浓度的溶液的配制步骤选择仪器;
(3)根据配制一定物质的量浓度的溶液的步骤进行排序;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 (1 )浓硫酸的物质量浓度为:$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,验室需要240mL 4.6mol/L的稀硫酸,应选择250mL容量瓶,实际配制时需要配制250mL的稀硫酸,设需要浓硫酸体积为V,依据稀释过程中溶质的物质的量不变得:4.6mol/L×0.25L=18.4L/mol×V,解得:0.0625L=62.5mL,
故答案为:18.4mol/L,62.5;
(2)配制一定物质的量浓度的溶液的配制步骤:计算、量取、稀释、冷却、转移、洗涤、定容等,需要的仪器有:量筒、烧杯、胶头滴管、玻璃棒、250mL容量瓶,所以还需要玻璃棒和250mL容量瓶,
故答案为:玻璃棒;250mL的容量瓶;
(3)配制一定物质的量浓度的溶液的配制步骤:计算、量取、稀释、冷却、转移、洗涤、定容等,所以正确的顺序为:CBDFAE;
故答案为:CBDFAE;
(4)A、量取浓H2SO4时俯视刻度,导致所取硫酸的物质的量偏小,溶液的浓度偏低,故A选;
B、容量瓶洗净后未经干燥处理,对溶质的物质的量和溶液的体积都不产生影响,溶液的浓度不变,故B不选;
C、将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作,没有冷却,导致冷却后配制的溶液的体积偏小,溶液的浓度偏大,故C不选;
D、定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏低,故D选;
故选:AD.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,熟悉配制过程和原理是解题关键,注意误差分析的方法与技巧,题难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| 选项 | 应用 | 解释 |
| A | 保持硫酸亚铁溶液需要加入铁钉和少量稀盐酸 | 防止Fe2+水解以及被O2氧化 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色 | BaCl2有酸性 |
| C | 在位置溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解 | 该位置溶液中一定存在SO42-或SO32- |
| D | 在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液观察并比较实验现象 | 可以探究催化剂FeCl3对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 苛性钠 | B. | 碱石灰 | C. | 盐酸 | D. | 铝 |
| A. | 自来水 | B. | 0.5 mol/L盐酸 | C. | 0.5 mol/LH2SO4 | D. | 0.5 mol/L NaNO3 |

有关氢氧化物开始沉淀和沉淀完全的pH见下表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(2)试剂A是H2O2(填化学式).
(3)调节酸浸液的pH的范围是3.7~5.4.
(4)滤液甲与试剂B发生置换反应,则试剂B是Zn(填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是坩埚.
| A. | 氯水中加少量的Na2 CO3粉末,可提高溶液中HC1O的浓度 | |
| B. | 金属单质都具有一定的还原性,金属阳离子都只有氧化性 | |
| C. | 火灾现场自救方法是用湿毛巾捂住口鼻并向地势低的地方撤离 | |
| D. | 大气中的N2可作为制硝酸的原料 |
| A. | 过氧化钠的电子式:Na${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$Na | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: | |
| D. | 间二甲苯的结构简式: |

 ,合成M的流程图如下:
,合成M的流程图如下:


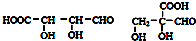 .
.