题目内容
在400℃时,将SO2和14molO2压入一个盛有催化剂的VL密闭容器中进行反应(2S2+O2?2SO3),2分钟时容器中剩下2molSO2和12molO2.则:
(1)2分钟内生成的SO3的物质的量是 ,SO2起始的物质的量是 .
(2)2分钟内以SO2浓度变化表示的平均反应速率是 .
(1)2分钟内生成的SO3的物质的量是
(2)2分钟内以SO2浓度变化表示的平均反应速率是
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,设二氧化硫起始量为x,生成三氧化硫物质的量为y
2SO2+O2?2SO3
起始量(mol) x 14 0
变化量(mol) y 0.5y y
平衡量(mol) 2 12 y
14-0.5y=12
y=4
x-y=2
x=6
(1)依据上述计算得到;
(2)反应速率v=
计算;
2SO2+O2?2SO3
起始量(mol) x 14 0
变化量(mol) y 0.5y y
平衡量(mol) 2 12 y
14-0.5y=12
y=4
x-y=2
x=6
(1)依据上述计算得到;
(2)反应速率v=
| △c |
| △t |
解答:
解:依据化学平衡三段式列式计算,设二氧化硫起始量为x,生成三氧化硫物质的量为y
2SO2+O2?2SO3
起始量(mol) x 14 0
变化量(mol) y 0.5y y
平衡量(mol) 2 12 y
14-0.5y=12
y=4
x-y=2
x=6
(1)2分钟内生成的SO3的物质的量是4mol,SO2起始的物质的量是6mol;
故答案为:4,6;
(2)2分钟内以SO2浓度变化表示的平均反应速率=
=
=
mol/L?min;
故答案为:
mol/L?min;
2SO2+O2?2SO3
起始量(mol) x 14 0
变化量(mol) y 0.5y y
平衡量(mol) 2 12 y
14-0.5y=12
y=4
x-y=2
x=6
(1)2分钟内生成的SO3的物质的量是4mol,SO2起始的物质的量是6mol;
故答案为:4,6;
(2)2分钟内以SO2浓度变化表示的平均反应速率=
| ||
| △t |
| ||
| 2min |
| 2 |
| V |
故答案为:
| 2 |
| V |
点评:本题考查了化学平衡影响因素分析计算,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在一定温度下,AgCl水溶液中Ag+和Cl-浓度的乘积是一个常数 |
| B、催化剂都不参与化学反应,反应前后质量、组成和性质都保持不变 |
| C、应用盖斯定律,可间接计算某些难以直接测量的反应热 |
| D、由于分子间氢键的存在,第VA族氢化物的沸点大小关系为:NH3>SbH3>AsH3>PH3 |
下列各组溶液不用其它试剂就能区别开的是( )
| A、BaCl2溶液和稀H2SO4 |
| B、NH4Cl溶液和NaOH溶液 |
| C、K2CO3溶液和稀H2SO4 |
| D、KI溶液和NaCl溶液 |
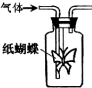 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )