题目内容
7.根据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,回答下列问题:(1)用双线桥法表示电子转移的方向和数目.
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
(2)氧化产物是Cu(NO3)2,还原产物是NO2.
(3)氧化剂与还原剂的物质的量之比为2:1.
分析 反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂;其得失电子数为2,所以其转移电子数为2,据此结合方程式分析.
解答 解:(1)反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂;其得失电子数为2,所以其转移电子数为2,即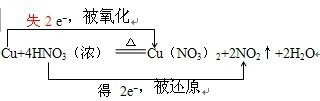 ,
,
故答案为: ;
;
(2)反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,所以铜是还原剂,生成的Cu(NO3)2是氧化产物,HNO3→NO2,N元素由+5价→+4价,所以生成的NO2为还原产物,故答案为:Cu(NO3)2;NO2;
(3)由反应方程式:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,氧化剂的物质的量即还原产物二氧化氮的物质的量是2mol,还原剂即铜的物质的量:1mol,所以氧化剂和还原剂的物质的量之比2:1,故答案为:2:1.
点评 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列反应属于取代反应的是( )
| A. | 乙酸乙酯在酸性条件下水解 | B. | 乙炔使溴的四氯化碳溶液褪色 | ||
| C. | 由乙醇制乙烯 | D. | 甲苯使酸性KMnO4溶液褪色 |
18.在一容积可变的密闭容器中,存在2HI(g)?H2(g)+I2(g)△H>0.欲使体系颜色加深,可采取的措施是( )
| A. | 缩小容器的体积 | B. | 在体积不变的情况下充入适量H2 | ||
| C. | 适当降低温度 | D. | 在保持压强不变情况下充入适量N2 |
15.下列各组离子,在指定的条件下一定能大量共存的是( )
| A. | 含有大量HCO3-的溶液中:NH4+、Na+、AlO2-、Cl- | |
| B. | PH=13的溶液中:Cl-、CO32-、K+、Na+ | |
| C. | 水电离c(OH-)=10-10mol/L的溶液中:NH4+、Na+、I-、Cl- | |
| D. | 能使甲基橙显红色的溶液中:Fe2+、K+、Cr2O72-、SO42- |
12.将浓盐酸、浓硫酸和浓硝酸分别滴在三张蓝色石蕊试纸上,这三张试纸最后的颜色是( )
| A. | 红、红、红 | B. | 红、黑、白 | C. | 红、黑、红 | D. | 白、黑、红 |
16.vmL密度为ρg/cm3的某溶液中,含有相对分子质量为M的溶质mg,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是( )
| A. | $C=\frac{1000m}{VM}$ | B. | $C=\frac{1000ρW}{M}$ | C. | $W%=\frac{CM}{1000ρ}$ | D. | $m=\frac{VρW}{1000}$ |
1.甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们在一定条件下的转化关系如图所示(部分产物已略去),下列各组物质中符合图示关系转化的是( )
| 选项 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| A |  | AgNO3(aq) | AgOH(s) | Ag(NH3)2OH(aq) | NH3?H2O(aq) |
| B | S(s) | SO3(g) | SO2(g) | O2(g) | |
| C | NaOH(aq) | NaHCO3(aq) | Na2CO3(aq) | CO2(g) | |
| D | Fe(s) | Fe(NO3)2(aq) | Fe(NO3)3(aq) | HNO3(aq) |
| A. | A | B. | B | C. | C | D. | D |