题目内容
将9g铜和铁的混合物投入到100mL稀硝酸中,充分反应后得到标准状况下1.12LNO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12LNO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是( )
| A、原混合物中铜和铁各0.075 mol |
| B、稀硝酸的物质的量浓度为2.0 mol?L-1 |
| C、第一次剩余4.8 g 金属为铜和铁 |
| D、向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,再结合选项解答.
A.根据上述计算确定混合物中铜和铁的物质的量;
B.根据NO的体积,结合方程式计算硝酸物质的量,进而计算硝酸浓度;
C.计算混合物中Fe、Cu质量进行判断;
D.向反应后的溶液中再加入该稀硝酸100 mL,亚铁离子与硝酸反应生成NO与硝酸铁,根据电子转移守恒计算.
A.根据上述计算确定混合物中铜和铁的物质的量;
B.根据NO的体积,结合方程式计算硝酸物质的量,进而计算硝酸浓度;
C.计算混合物中Fe、Cu质量进行判断;
D.向反应后的溶液中再加入该稀硝酸100 mL,亚铁离子与硝酸反应生成NO与硝酸铁,根据电子转移守恒计算.
解答:
解:A.整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,有:56x+64y=9、
(x+y)=
,联立方程,解得:x=0.075mol、y=0.075mol,A.由上述分析可知,原混合物中铜和铁各0.075mol,故A正确;
B.根据方程式可知,n(HNO3)=4n(NO)=0.4mol,稀硝酸的物质的量浓度为
=2mol/L,故B正确;
C.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075mol×64g/mol=4.8g,故第一次剩余金属4.8g为Cu的质量,故C错误;
D.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为
=0.025mol,其体积为0.025mol×22.4L/mol=0.56L,故D正确;
故选C.
| 2 |
| 3 |
| 2.24 |
| 22.4 |
B.根据方程式可知,n(HNO3)=4n(NO)=0.4mol,稀硝酸的物质的量浓度为
| 0.4mol |
| 0.2L |
C.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075mol×64g/mol=4.8g,故第一次剩余金属4.8g为Cu的质量,故C错误;
D.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为
| 0.075mol×1 |
| 3 |
故选C.
点评:本题考查混合物的有关计算,难度中等,利用整体法解答及判断最终的产物是关键,避免了过程法的繁琐,侧重对学生思维能力的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列除杂质(括号内为杂质)的方法正确的是( )
| A、苯(甲苯):加酸性KMnO4溶液,振荡后分液 |
| B、甲烷(乙烯):通过盛有溴水的洗气瓶 |
| C、乙醇(丙三醇):用分液漏斗分液 |
| D、苯(苯酚):加浓溴水,后过滤 |
常温时,将V1mL c1mol/L的氨水滴加到V2mL c2mol/L的盐酸中,下述结论一定正确的是( )
| A、若V1>V2,c1=c2,则混合溶液的PH>7 |
| B、若混合溶液的PH=7,则c1V1<c2V2 |
| C、若c1=c2,混合溶液中c(NH4+)=c(Cl-),则V1>V2 |
| D、以上说法均不正确 |
下列溶液中的c(Cl-)与50mL1mol/L氯化铝溶液中的c(Cl-)相等的是( )
| A、150mL1mol/L氯化钠溶液 |
| B、75mL2mol/L 氯化铵溶液 |
| C、150mL1mol/L氯化钾溶液 |
| D、75mL3mol/L氯化钾溶液 |
nmolN2和nmol14CO(相对分子质量为30)相比较,下列叙述中正确的是( )
| A、二者的体积相等 |
| B、在同温同压下密度相等 |
| C、在标准情况下质量相等 |
| D、二者的分子数相等 |
对于反应aA+bB=dD+eE,若已知40g A可恰好与21g B完全反应生成28g D,则B与E的摩尔质量比为( )
| A、7a:10d |
| B、10a:7d |
| C、10b:7e |
| D、7e:11b |
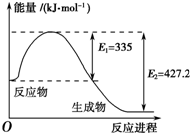 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题: