题目内容
下列各组反应中最终肯定有白色沉淀的是( )
| A、向CaCl2中通入少量的CO2 |
| B、Na2CO3溶液中加入过量CO2 |
| C、NaAlO2溶液中通入过量CO2 |
| D、Fe2(SO4)3溶液中加入过量KOH溶液 |
考点:钠的重要化合物,铁盐和亚铁盐的相互转变
专题:
分析:A.碳酸酸性弱于盐酸;
B.碳酸钠与二氧化碳和水反应生成碳酸氢钠,碳酸钠溶解度大于碳酸氢钠,如果碳酸钠溶液为饱和溶液,通入过量二氧化碳会产生沉淀,如果碳酸钠溶液不是饱和溶液,不会产生沉淀;
C.NaAlO2溶液通入过量二氧化碳,反应生成氢氧化铝和碳酸氢钠;
D.Fe2(SO4)3溶液中加入过量KOH溶液,反应生成氢氧化铁沉淀,氢氧化铁为红褐色.
B.碳酸钠与二氧化碳和水反应生成碳酸氢钠,碳酸钠溶解度大于碳酸氢钠,如果碳酸钠溶液为饱和溶液,通入过量二氧化碳会产生沉淀,如果碳酸钠溶液不是饱和溶液,不会产生沉淀;
C.NaAlO2溶液通入过量二氧化碳,反应生成氢氧化铝和碳酸氢钠;
D.Fe2(SO4)3溶液中加入过量KOH溶液,反应生成氢氧化铁沉淀,氢氧化铁为红褐色.
解答:
解:A.碳酸酸性弱于盐酸,依据强酸制备弱酸的反应原理,向CaCl2中通入少量的CO2不会发生反应生成沉淀,故A错误;
B.碳酸钠与二氧化碳和水反应生成碳酸氢钠,碳酸钠溶解度大于碳酸氢钠,如果碳酸钠溶液为饱和溶液,通入过量二氧化碳产生沉淀,如果碳酸钠溶液不是饱和溶液,不会产生沉淀,故B错误;
C.NaAlO2溶液通入过量二氧化碳,反应生成氢氧化铝和碳酸氢钠,氢氧化铝为白色沉淀,故C正确;
D.Fe2(SO4)3溶液中加入过量KOH溶液,反应生成氢氧化铁沉淀,氢氧化铁为红褐色,故D错误;
故选:C.
B.碳酸钠与二氧化碳和水反应生成碳酸氢钠,碳酸钠溶解度大于碳酸氢钠,如果碳酸钠溶液为饱和溶液,通入过量二氧化碳产生沉淀,如果碳酸钠溶液不是饱和溶液,不会产生沉淀,故B错误;
C.NaAlO2溶液通入过量二氧化碳,反应生成氢氧化铝和碳酸氢钠,氢氧化铝为白色沉淀,故C正确;
D.Fe2(SO4)3溶液中加入过量KOH溶液,反应生成氢氧化铁沉淀,氢氧化铁为红褐色,故D错误;
故选:C.
点评:本题考查了元素化合物知识,明确离子反应发生的条件及氢氧化铁的颜色是解题关键,注意A选项为易错选项.

练习册系列答案
相关题目
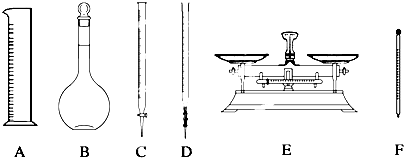
下列有关实验操作的说法错误的是( )
| A、中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B、在酸碱中和滴定实验中,滴定管都需润洗,否则引起误差 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
实验室用NaCl固体配480mL 1.0mol/LNaCl溶液,下列判断不对的是( )
| A、用托盘天平称取NaCl固体29.25g |
| B、应选用500 mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
SO2Cl2是一种重要的试剂,可用如下方法制备:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0.下列措施既能加快反应速率又能提高SO2转化率的是( )
| A、升高温度 |
| B、缩小容器体积 |
| C、增大容器体积 |
| D、降低温度 |
下列物质中互为同分异构体的是( )
| A、O2和O3 |
B、 和 和  |
| C、CH3COOH和HCOOCH3 |
D、 和 和  |