题目内容
2.
(1)将碳与水蒸气在高温下反应制得水煤气.水煤气的主要成分是CO和H2,两者的体积比约为l:l.
已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111.0kJ•mol-1;
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1.
写出由C(s)与H2O(g)反应生成水煤气的热化学方程式:C(s)+H2O(g)=H2(g)+CO(g)△H=+131kJ•mol-1.
(2)为减弱温室效应,有一种思路是将CO2转化成其它可燃物质.工业上已实现CO2和H2反应生成甲醇的转化.已知:在一体积恒定为1L的恒温密闭容器中充入l mol CO2和
3mol H2,一定条件下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
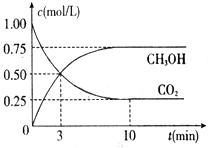
△H=-50.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如右图所示.请回答:
①反应进行到10min时放出的热量为37.5kJ.
②在前10min内,用H2浓度的变化表示的反应速率v(H2)=0.225 mol•L-1•min-1.
③能判断该反应达到化学平衡状态的依据是ABF.
A.容器压强不变 B.混合气体中c(CO2)不变
C.vCH3OH)=vH2O) D.c(CH3OH)=c(H2O)
E.混合气体的密度不变 F.混合气体的平均相对分子质量不变
④该反应平衡常数的表达式为$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$.
⑤反应达到平衡后,若往平衡体系中再加入1mol CO2、3mol H2并达到新的平衡,与原平衡相比,CO2的物质的量浓度增大(填“增大”“不变”或“减小”,下同),H2的转化率增大.
分析 (1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111.0kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1,
根据盖斯定律①-②可得C(s)+H2O(g)=H2(g)+CO(g),据此计算;
(2)①由图知反应在10min达到平衡,反应二氧化碳0.75mol,根据热化学方程式计算此时放出的热量;
②由二氧化碳的转化量计算氢气的转化量,根据v=$\frac{△c}{△t}$计算速率;
③根据化学平衡时正逆反应速率相等,各组分含量保持不变分析各选项;
④根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比计算K;
⑤往平衡体系中再加入1mol CO2、3mol H2,达到的新平衡相当于对两个相同的原平衡压缩体积达到的新平衡状态,根据压强对化学平衡的影响可得.
解答 解:(1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111.0kJ•mol-1;
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1.
根据盖斯定律①-②可得C(s)+H2O(g)=H2(g)+CO(g)△H=+131 kJ•mol-1;
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131 kJ•mol-1;
(2)①由图知反应在10min达到平衡,二氧化碳为0.25mol,则反应二氧化碳为:1mol-0.25mol=0.75mol,从题可知1mol二氧化碳充分反应放热50kJ的热量,则0.75mol二氧化碳反应放出的热量为:0.75×50=37.5KJ;
故答案为:37.5kJ;
②前10min内,反应二氧化碳0.75mol,根据化学方程式,反应氢气为:0.75mol×3=2.25mol,则用氢气表示的反应速率为:$\frac{2.25mol÷1L}{10min}$=0.225mol•L-1•min-1;
故答案为:0.225;
③A.反应气体体积前后改变,恒容体系压强改变,平衡时,容器压强不变,故正确;
B.平衡时,混合气体中c(CO2)不变,故正确;
C.vCH3OH)=vH2O,为说明正逆反应速率,故错误;
D.c(CH3OH)=c(H2O),不能说明反应达到平衡,故错误;
E.混合气体的总质量不变,恒容混合气体体积不变,则混合气体的密度始终不变,故错误;
F.混合气体的总质量不变,混合气体总物质的量减小,混合气体的平均相对分子质量变大,平衡时,很合气体的平均相对分子质量不变,故正确;
故答案为:ABF;
④反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)的化学平衡常数表达式为:$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
⑤再加入1mol CO2、3mol H2,达到的新状态可看做是两个原来的平衡压缩体积达到的平衡状态,若平衡不移动,CO2的物质的量浓度为原来的两倍,H2的转化率不变,但该反应是个气体体积减小的反应,增大压强,化学平衡正向移动,则CO2的物质的量浓度比原来大,但是比原来两倍小,H2的转化率增大;
故答案为:增大;增大.
点评 本题主要考查了化学反应速率的计算,化学平衡的特征,平衡常数的表达式书写、影响化学平衡的因素等知识点,中等难度,解题要注意基础知识的运用.

| A. | 钠在氯气中燃烧制氯化钠 | |
| B. | 二氧化锰和浓盐酸共热制氯气 | |
| C. | 氯气与消石灰反应制漂白粉 | |
| D. | 氢气、氯气混合光照后的产生溶于水制盐酸 |
| W | X | Y | Z |
| 单质是淡黄色固体 | 与W同周期,其单质常用作半导体材料 | 原子最外层电子数是电子总数的$\frac{2}{3}$ | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 简单离子半径:Z>W | |
| D. | 工业上用Y单质还原Z的氧化物得Z的单质 |
| A. | 用稀AgNO3溶液洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| B. | 对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 | |
| C. | 已知AgCl的 KSP=1.8×10-10,将AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| D. | 将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,说明AgCl溶解度大于AgI |
| 实验 序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.63g,第二次称量读数为4.66g |
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是Ba2+、Mg2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 | 物质的量浓度(mol/L) |
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下: .
.