题目内容
已知:在一定温度下,微溶电解质Ca(OH)2在饱和溶液中建立沉淀-溶解平衡:Ca(OH)2(固)?Ca2++2OH-溶度积常数Ksp=[Ca2+][OH-]2.冬天许多马路两旁的树干都均匀整齐地涂抹了石灰水,下列有关说法不正确的是( )
| A、饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 |
| B、升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 |
| C、饱和石灰水中加入生石灰,若保持温度不变,则pH不变 |
| D、向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、加入的生石灰和水反应生成氢氧化钙,水少了,原来的饱和溶液要析出氢氧化钙;
B、饱和石灰水的溶解度随温度升高而减小;
C、饱和溶液的浓度与温度有关;
D、向饱和石灰水中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),增大钙离子浓度平衡逆移.
B、饱和石灰水的溶解度随温度升高而减小;
C、饱和溶液的浓度与温度有关;
D、向饱和石灰水中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),增大钙离子浓度平衡逆移.
解答:
解:A、加入的生石灰和水反应生成氢氧化钙,水少了,原来的饱和溶液要析出氢氧化钙,则溶液中Ca2+的物质的量减少,故A错误;
B、饱和石灰水的溶解度随温度升高而减小,所以升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小,故B正确;
C、向饱和石灰水中加少量生石灰反应后,仍为饱和溶液,饱和溶液的浓度与温度有关,温度不变,则饱和溶液浓度不变,所以PH不变,故C正确;
D、向饱和石灰水中存在Ca(OH)2 (s)?Ca2+(aq)+2OH-(aq),增大钙离子浓度平衡逆移,会析出Ca(OH)2沉淀,故D正确;
故选:A.
B、饱和石灰水的溶解度随温度升高而减小,所以升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小,故B正确;
C、向饱和石灰水中加少量生石灰反应后,仍为饱和溶液,饱和溶液的浓度与温度有关,温度不变,则饱和溶液浓度不变,所以PH不变,故C正确;
D、向饱和石灰水中存在Ca(OH)2 (s)?Ca2+(aq)+2OH-(aq),增大钙离子浓度平衡逆移,会析出Ca(OH)2沉淀,故D正确;
故选:A.
点评:本题考查难溶电解质的溶解平衡,题目难度不大,本题注意Ca(OH)2溶解度随温度升高而减小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于下列四个说法正确的是( )
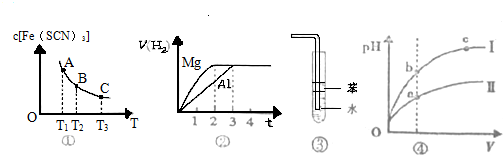

| A、已知图①是体系Fe3++3SCN-?Fe(SCB)3中c[Fe(SCN)3]与温度T的平衡图象,则A点与B点相比,A点的Fe3+浓度大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③可用于吸收HCl气体,并防倒吸 |
| D、图④是某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,II为醋酸稀释时pH的变化曲线 |
已知:同温度下的溶解度Zn(OH)2>ZnS>MgCO3>Mg(OH)2,就溶解或电离出S2-的能力而言,FeS>H2S>CuS则以下离子方程式错误的是( )
| A、Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O |
| B、Cu2++H2S=Cu S↓+2H+ |
| C、Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
| D、FeS+2H+=Fe2++H2S↑ |
某同学想对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾分解反应中的催化作用进行如下实验:
下列叙述不正确的是( )
| 实验 编号 |
KClO3(g) | 氧化物 | 产生气体(mL) (已折算为标况) |
耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2(有刺激性气味) | 188.3 |
| A、催化剂的催化能力Fe2O3>MnO2>CuO |
| B、实验2、3、4中KClO3分解百分率相同 |
| C、实验1设计对本实验无意义 |
| D、Cr2O3在反应中起到还原剂作用 |
如图所示与对应的叙述相符的是( )
A、 四种基本反应类型与氧化还原反应的关系 |
B、 AlCl3溶液滴加NaOH溶液生成沉淀的情况 |
C、 Ba(OH)2溶液中滴加硫酸溶液导电性的情况 |
D、 等体积等浓度稀硫酸分别与足量铁和镁反应的情况 |
 已知A、B、D、E四种物质均含有氧元素.D为气体单质,E为黑色粉末.A和B分别经E催化都会分解产生D.B通常为液态,由两种元素组成,原子个数比为1:1,且1molB含18mol电子.试回答下列问题.
已知A、B、D、E四种物质均含有氧元素.D为气体单质,E为黑色粉末.A和B分别经E催化都会分解产生D.B通常为液态,由两种元素组成,原子个数比为1:1,且1molB含18mol电子.试回答下列问题.
 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示: