题目内容
将0.1mol/L的下列物质的水溶液从常温加热到80℃,溶液的pH值不变的是( )
| A、CH3COOH |
| B、H2SO4 |
| C、NH4Cl |
| D、NaOH |
考点:弱电解质在水溶液中的电离平衡,影响盐类水解程度的主要因素
专题:电离平衡与溶液的pH专题
分析:A、根据温度对CH3COOH的电离的影响来分析;
B、酸的浓度不变,则氢离子的浓度不变来分析pH;
C、根据温度对盐的水解影响来分析;
D、根据温度对水的离子积的影响来分析碱溶液中的pH.
B、酸的浓度不变,则氢离子的浓度不变来分析pH;
C、根据温度对盐的水解影响来分析;
D、根据温度对水的离子积的影响来分析碱溶液中的pH.
解答:
解:A、因升高温度CH3COOH,促进电离,氢离子浓度变大,PH变小,故A错误;
B、因升高温度时硫酸中的氢离子浓度不变,则溶液的pH不变,故B正确;
C、升高温度促进水解,氢离子浓度越大,PH变小,故C错误;
D、升高温度时NaOH溶液中氢氧根离子的浓度不变,但升高温度时水的离子积变大,则氢离子的浓度变大,故溶液的pH变小,故D错误;
故选B.
B、因升高温度时硫酸中的氢离子浓度不变,则溶液的pH不变,故B正确;
C、升高温度促进水解,氢离子浓度越大,PH变小,故C错误;
D、升高温度时NaOH溶液中氢氧根离子的浓度不变,但升高温度时水的离子积变大,则氢离子的浓度变大,故溶液的pH变小,故D错误;
故选B.
点评:本题考查溶液的pH,明确pH的计算与溶液中的氢离子的浓度有直接关系是解答本题的关键,并注意温度对盐类水解及弱电解质的电离的影响来解答.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
钙是人体必需的常量元素,成年人每天需要800毫克的钙,下列补钙的途径正确的是( )
| A、经常饮用咖啡、碳酸饮料 |
| B、经常饮用钙离子含量高的硬水 |
| C、经常饮用牛奶、豆奶 |
| D、大量补充维生素C |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、C2O42- |
| B、0.1mol/LFeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
| C、0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、水电离出来的c(H+)=1×10-13mol/L的溶液中:Fe2+、Cu2+、SO42-、NO3- |
下列各组物质中,前者为强电解质,后者为弱电解质的是( )
| A、碳酸氢钠,醋酸 |
| B、食盐,酒精 |
| C、硫酸,硫酸镁 |
| D、碳酸,碳酸钠 |
下列反应中,二氧化硫既不做氧化剂,又不作还原剂的是( )
A、2SO2+O2
| ||||
| B、SO2+2H2S═3S↓+2H2O | ||||
| C、SO2+NaOH═NaHSO3 | ||||
| D、SO2+Cl2+H2O═H2SO4+2HCl |
某由离子化合物组成的混合物只可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-.为确定其组成,准确称取14.82g混合物溶于水得300mL澄清溶液,分成三等份分别进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液并加热,经碱石灰干燥后收集到标况下气体1.12L
(3)第三份加足量BaCl2溶液,沉淀经洗涤、干燥后称重为6.27g,再向沉淀中加足量盐酸,经过滤、洗涤、干燥后称重为2.33g
根据上述实验,以下推测不正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液并加热,经碱石灰干燥后收集到标况下气体1.12L
(3)第三份加足量BaCl2溶液,沉淀经洗涤、干燥后称重为6.27g,再向沉淀中加足量盐酸,经过滤、洗涤、干燥后称重为2.33g
根据上述实验,以下推测不正确的是( )
| A、溶液中c(SO42-)为0.1mol/L、c(CO32-) 为0.2mol/L |
| B、该混合物中不含Ba2+、Mg2+ |
| C、一定存在NH4+、K+,无法确定Cl-是否存在 |
| D、实验(3)沉淀中加盐酸后,若只过滤、不洗涤,会对除NH4+外的其他离子含量的测定造成影响 |
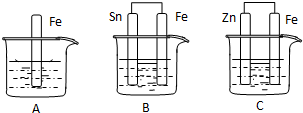 如图所示,烧杯中都盛有稀硫酸.
如图所示,烧杯中都盛有稀硫酸.