题目内容
19.向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液中碳酸氢根离子滚度的变化趋势是先逐渐增大,而后减小.分析 碳酸钠为二元弱酸对应的正盐,逐滴加入盐酸,先发生反应生成酸式盐,再生成二氧化碳气体和水.
解答 解:碳酸钠为二元弱酸对应的正盐,逐滴加入盐酸,先发生反应生成酸式盐,反应的离子方程式为:CO32-+H+═HCO3-,此时溶液中的碳酸氢根离子浓度逐渐增大,当完全生成碳酸氢根离子时,继续反应生成二氧化碳和水,反应的离子方程式为HCO3-+H+═H2O+CO2↑,溶液中的碳酸氢根离子浓度又逐渐减小,
故答案为:先逐渐增大,而后减小.
点评 本题考查离子方程式的书写,题目难度不大,注意有关物质的性质以及相关基础知识的积累,把握反应的先后顺序为解答的关键.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
10. 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | Na2SO3溶液 | D. | 饱和NaCl溶液 |
7.沼气的主体是甲烷.0.5mol CH4完全燃烧为CO2和H2O(l)时,放出445kJ的热量.则甲烷燃烧的热化学方程式是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol | |
| B. | 2 CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+1780kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ/mol | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=-1780kJ/mol |
14.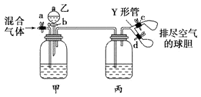 用如图装置来分离CO2和CO混合气体,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )
用如图装置来分离CO2和CO混合气体,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )
 用如图装置来分离CO2和CO混合气体,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )
用如图装置来分离CO2和CO混合气体,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )| 甲 | 乙 | 丙 | |
| A | 饱和NaHCO3溶液 | 12mol•L-1盐酸 | 18.4mol•L-1 H2SO4 |
| B | 饱和Na2CO3溶液 | 2mol•L-1 H2SO4 | 饱和NaOH溶液 |
| C | 饱和NaOH溶液 | 2mol•L-1 H2SO4 | 18.4mol•L-1 H2SO4 |
| D | 18.4mol•L-1 H2SO4 | 饱和NaOH溶液 | 18.4mol•L-1 H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
4.下列有关实验操作的说法正确的是( )
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 可用25mL酸式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 用pH计测得某溶液的pH为2 |
9.某学习小组为探究MnO2与FeCl3•6H2O的反应,设计了下列装置如图1:
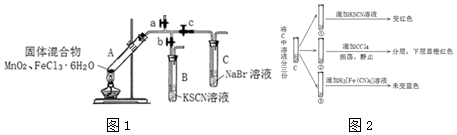
实验前查到信息:
①FeCl3熔点282℃,沸点315℃,FeCl3 $\frac{\underline{\;高温\;}}{\;}$ FeCl2+Cl2↑
②FeCl3•6H2O 熔点37℃,沸点285℃
实验过程记录:
回答下列问题:
(1)A中的白雾是盐酸小液滴.
(2)管壁内形成黄色液滴,可能的原因是FeCl3•6H2O受热气化,在管壁遇冷所致.
(3)B中溶液变红,用化学用语解释原因是Fe3++3SCN-=Fe(SCN)3.
(4)对C中溶液变黄色,小组展开进一步实验如图2:
Ⅰ.C中变黄的原因是Fe3+和Br2共同导致.
Ⅱ.C中发生反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(5)对A中残留物进行分离,其中得到一种不溶于水的红色固体,A中发生化学反应的方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验前查到信息:
①FeCl3熔点282℃,沸点315℃,FeCl3 $\frac{\underline{\;高温\;}}{\;}$ FeCl2+Cl2↑
②FeCl3•6H2O 熔点37℃,沸点285℃
实验过程记录:
| 操作步骤 | 现象 |
| 1检查装置气密性,添加相应药品,点燃酒精灯,开始给A加热 | |
| 2打开a,关闭b、c,用湿润蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
| 3打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
| 4打开c,关闭a、b | C中溶液变棕黄色 |
| 5停止加热 |
(1)A中的白雾是盐酸小液滴.
(2)管壁内形成黄色液滴,可能的原因是FeCl3•6H2O受热气化,在管壁遇冷所致.
(3)B中溶液变红,用化学用语解释原因是Fe3++3SCN-=Fe(SCN)3.
(4)对C中溶液变黄色,小组展开进一步实验如图2:
Ⅰ.C中变黄的原因是Fe3+和Br2共同导致.
Ⅱ.C中发生反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(5)对A中残留物进行分离,其中得到一种不溶于水的红色固体,A中发生化学反应的方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
 “套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:
“套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题: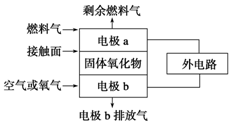 固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动.当燃料气为C2H4时,其正极、负极反应式分别为
固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动.当燃料气为C2H4时,其正极、负极反应式分别为