题目内容
19.下列对实验装置图、实验操作及结论描述正确的是( )| A. | 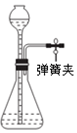 打开弹簧夹,由漏斗中加水至产生液面差,液面高度差不变时,说明装置气密性良好 | |
| B. | 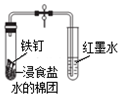 打开弹簧夹一段时间后,红墨水倒吸入导气管中,说明铁钉发生了析氢腐蚀 | |
| C. | 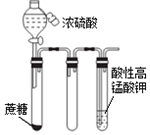 滴入浓硫酸后一段时间,高锰酸钾溶液褪色,说明产生了还原性气体 | |
| D. | 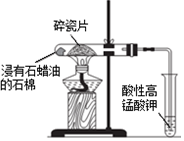 加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯 |
分析 A.检验气密性时,关闭弹簧夹,由漏斗中加水至产生液面差;
B.食盐水为中性,发生吸氧腐蚀;
C.浓硫酸具有脱水性,蔗糖炭化后,C与浓硫酸发生氧化还原反应生成二氧化硫;
D.需要对碎瓷片加强热.
解答 解:A.检验气密性时,关闭弹簧夹,由漏斗中加水至产生液面差,则液面高度差不变时,说明装置气密性良好,不能打开弹簧夹,故A错误;
B.食盐水为中性,发生吸氧腐蚀,红墨水倒吸入导气管中,故B错误;
C.浓硫酸具有脱水性,蔗糖炭化后,C与浓硫酸发生氧化还原反应生成二氧化硫,锰酸钾溶液褪色,说明产生了还原性气体为二氧化硫,故C正确;
D.需要对碎瓷片加强热,加热片刻不能产生乙烯,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握气密性检验、化学腐蚀、物质的性质为解答的关键,侧重分析与实验能力的考查,选项D为解答的难点,注意实验基本操作和与实验技能,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):
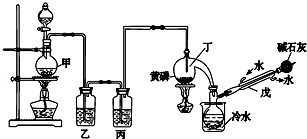
有关物质的部分性质如下:
请回答下列问题:
(1)仪器戊的名称为冷凝管.
(2)实验时甲中所发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)乙中盛放的试剂是饱和氯化钠溶液,其作用是除去氯气中的氯化氢;丙中盛放的试剂是浓硫酸,其作用是除去氯气中的水蒸气.
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是排净装置中的空气,防止空气中的水分和氧气与PCl3反应
(5)碱石灰的作用是碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度(答出一条即可).
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为3PCl5+2P$\frac{\underline{\;\;△\;\;}}{\;}$5PCl3,后通过蒸馏(填实验操作名称),即可得到PCl3纯品.

有关物质的部分性质如下:
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(1)仪器戊的名称为冷凝管.
(2)实验时甲中所发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)乙中盛放的试剂是饱和氯化钠溶液,其作用是除去氯气中的氯化氢;丙中盛放的试剂是浓硫酸,其作用是除去氯气中的水蒸气.
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是排净装置中的空气,防止空气中的水分和氧气与PCl3反应
(5)碱石灰的作用是碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度(答出一条即可).
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为3PCl5+2P$\frac{\underline{\;\;△\;\;}}{\;}$5PCl3,后通过蒸馏(填实验操作名称),即可得到PCl3纯品.
10.用红色激光照射下列物质,能观察到丁达尔效应的是( )
| A. | 乙醇溶液 | B. | 氢氧化铁胶体 | C. | 酸酸铜溶液 | D. | 蔗糖溶液 |
7.下列各种试纸,在使用时预先不能用蒸镏水润湿的是( )
| A. | 红色石蕊试纸检验NH3 | B. | 品红试纸检验SO2 | ||
| C. | 碘化钾淀粉试纸检验Cl2 | D. | pH试纸检验溶液的pH |
14.可以用于鉴别淀粉溶液和蛋白质溶液的方法是( )
| A. | 分别加入碘化钾溶液,观察颜色变化 | |
| B. | 分别加热,观察是否生成沉淀 | |
| C. | 分别滴加浓硝酸 | |
| D. | 分别灼烧,闻味道 |
4.我国古代科技高度发达,下列有关古代文献的说法,错误的是( )
| A. | 明朝的《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露.”该段文字记载了白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯 | |
| B. | 汉朝的《淮南万毕术》、《神农本草经》记载“白青(碱式碳酸铜)得铁化为铜”,“石胆…能化铁为铜”都是指铜可以采用湿法冶炼 | |
| C. | 清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之.”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 | |
| D. | 晋代葛洪的《抱朴子》记载“丹砂烧之成水银,积变又成丹砂”,是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体 |
11.摩尔是( )
| A. | 国际单位制的一个基本物理量 | B. | 表示物质质量的单位 | ||
| C. | 物质的量的单位 | D. | 表示物质数量的单位 |
8.已知在碱性溶液中可发生如下反应:Fe(OH)3+ClO-+OH-→FeO4n-+Cl-+H2O (未配平).则有关叙述不正确的是( )
| A. | 已知FeO4n-中Fe的化合价是+6价,则n=2 | |
| B. | 每产生1molCl-,转移2mol电子 | |
| C. | FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂 | |
| D. | 若n=2,该反应中氧化剂与还原剂的物质的量之比为2:3 |
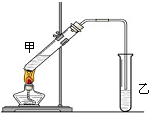 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: CH3COOC2H5+H2O、CH3COOH+Na2CO3=NaHCO3+CH3COONa.
CH3COOC2H5+H2O、CH3COOH+Na2CO3=NaHCO3+CH3COONa.