题目内容
下列关于0.2mol/L硝酸钾溶液的叙述中,正确的是( )
| A、1L该溶液中含硝酸钾202g |
| B、100mL该溶液中含硝酸钾0.02mol |
| C、从1L该溶液中取出500mL后,剩余溶液的浓度为0.1mol/L |
| D、1L水中溶解0.2mol硝酸钾,即可配得0.2mol/L硝酸钾溶液 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、依据n=CV=
计算;
B、依据溶质物质的量n=CV计算得到;
C、溶液时均一稳定的分散系,溶质浓度与溶液体积无关;
D、1L水中溶解0.2mol硝酸钾,得到溶液体积大于1L;
| m |
| M |
B、依据溶质物质的量n=CV计算得到;
C、溶液时均一稳定的分散系,溶质浓度与溶液体积无关;
D、1L水中溶解0.2mol硝酸钾,得到溶液体积大于1L;
解答:
解:A、1L 0.2mol/L硝酸钾溶液中溶质硝酸钾质量=1L×0.2mol/L×101g/mol=20.2g,故A错误;
B、100mL0.2mol/L硝酸钾溶液中含硝酸钾物质的量=0.1L×0.2mol/L=0.02mol,故B正确;
C、溶液时均一稳定的分散系,溶质浓度与溶液体积无关,从1L该溶液中取出500mL后,剩余溶液的浓度为0.2mol/L,故C错误;
D、1L水中溶解0.2mol硝酸钾,得到溶液体积大于1L,配得硝酸钾溶液浓度小于0.2mol/L,故D错误;
故选B.
B、100mL0.2mol/L硝酸钾溶液中含硝酸钾物质的量=0.1L×0.2mol/L=0.02mol,故B正确;
C、溶液时均一稳定的分散系,溶质浓度与溶液体积无关,从1L该溶液中取出500mL后,剩余溶液的浓度为0.2mol/L,故C错误;
D、1L水中溶解0.2mol硝酸钾,得到溶液体积大于1L,配得硝酸钾溶液浓度小于0.2mol/L,故D错误;
故选B.
点评:本题考查了溶液中溶质物质的量、物质的量浓度计算分析判断,掌握概念实质是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于外界条件的改变对化学反应速率影响的说法中正确的是( )
| A、升高温度能加快吸热反应速率,减慢放热反应速率 |
| B、增大压强能加快气体体积缩小方向的反应速率,减慢气体体积增大方向的反应速率 |
| C、压强的改变只有通过浓度的改变才能影响化学反应速率 |
| D、若外界条件的改变引起了正、逆反应速率的改变,就一定能引起化学平衡的移动 |
下列关于能源和作为能源的物质的叙述错误的是( )
| A、吸热反应的反应物总能量低于生成物总能量 |
| B、绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 |
| C、物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
| D、天然气属于二次能源 |
下列叙述正确的是( )
| A、含有最高价元素的化合物不一定具有强的氧化性 |
| B、得电子越多的氧化剂,其氧化性就越强 |
| C、在反应中失去电子的物质被还原,得到电子的物质被氧化 |
| D、氧化还原反应是一种物质首先被氧化,然后另一种物质再被还原的反应 |
下列离子方程式书写正确的是( )
| A、将铝片放入过量NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、硫酸铝溶液中加入过量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| D、铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag |
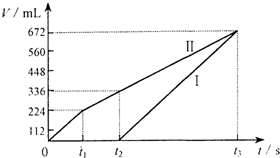 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测: