题目内容
铁和氧化铁的混合物共a mol,加一定量盐酸后固体全部溶解,得到的溶液中不含Fe3+,同时收集到b mol氢气,则原混合物中氧化铁的物质的量为( )
A、
| ||
B、
| ||
| C、(a-b)mol | ||
| D、b mol |
考点:有关混合物反应的计算
专题:
分析:铁和氧化铁的混合物中加入盐酸全部溶解,得到的溶液中不含Fe3+,根据生成氢气的物质的量计算与酸反应的铁的物质的量,其余的铁则和Fe2O3以等物质的量溶于盐酸生成FeCl2,即Fe+Fe2O3+6H+=3Fe2++3H2O,据此进行计算.
解答:
解:根据电子转移守恒,铁的物质的量与盐酸反应生成H2的物质的量相等,即:n(Fe)=n(H2)=bmol;
其余的铁与Fe2O3以等物质的量溶于盐酸生成FeCl2,发生反应为:Fe+Fe2O3+6H+=3Fe2++3H2O,
则参加该反应的氧化铁的物质的量为:
×(a-b)mol=
(a-b)mol,
故选A.
其余的铁与Fe2O3以等物质的量溶于盐酸生成FeCl2,发生反应为:Fe+Fe2O3+6H+=3Fe2++3H2O,
则参加该反应的氧化铁的物质的量为:
| 1 |
| 2 |
| 1 |
| 2 |
故选A.
点评:本题考查混合物有关计算,题目难度中等,明确反应原理为解题关键,注意利用总反应方程式解答,试题有利于考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、S02气体通入新制氯水中:SO2+2HC1O=2C1-+SO42-+2H+ |
| B、将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| C、向NaA102溶液中通入少量CO2:2A1O2-+CO2+3H2O=2A1(OH)3↓+CO32- |
| D、澄清石灰水与过量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O |
100mL 1mol/L H2SO4跟过量锌粉反应,恒温下,为减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量某物质或溶液,其中不能达到目的是( )
①醋酸钠(固体) ②水 ③硫酸钾溶液 ④硫酸铵(固体)⑤100mL 2mol/L硫酸氢铵溶液 ⑥将1mol/L硫酸改为18mol/L硫酸 ⑦硝酸钾溶液⑧将锌粉改为锌块.
①醋酸钠(固体) ②水 ③硫酸钾溶液 ④硫酸铵(固体)⑤100mL 2mol/L硫酸氢铵溶液 ⑥将1mol/L硫酸改为18mol/L硫酸 ⑦硝酸钾溶液⑧将锌粉改为锌块.
| A、①③④⑥ | B、④⑤⑥⑦ |
| C、①②③⑧ | D、③④⑤⑦ |
下列化合物中,在一定条件下既能发生取代反应,又能发生消去反应的是( )
| A、乙烯 | B、乙醇 | C、苯 | D、一氯甲烷 |
下列说法正确的是( )
| A、71 g氯相当于2 mol氯 |
| B、每摩尔物质中含有6.02×1023个原子 |
| C、阿伏加德罗常数为12 g 12C所含的碳原子数 |
| D、1 mol KClO3中含有3 mol氧元素 |

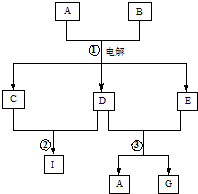 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)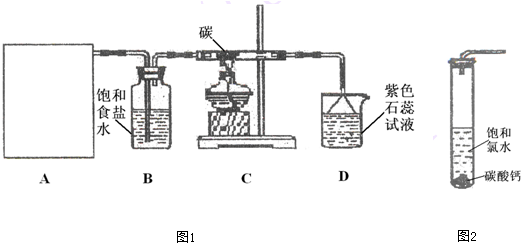
 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.根据所学知识,回答下列问题:
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.根据所学知识,回答下列问题: