题目内容
6.有M、N、P、E四种金属,①M+N2+=N+M2+;②M、P用导线连接放入稀盐酸中,M表面有大量气泡;③电解过程中,阴极存在N2+和E2+两种离子时,E2+优先放电.则四种金属的活动性由强到弱的顺序为( )| A. | E、N、M、P | B. | M、N、P、E | C. | P、M、N、E | D. | P、N、M、E |
分析 发生置换反应时,活泼金属能置换出不活泼金属,形成原电池反应时,表面有大量气泡作原电池的正极,发生还原反应,电解过程中,阴极存在N2+和E2+两种离子时,E2+优先放电,说明活泼性N>E,以此解答.
解答 解:①M+N2+=N+M2+,可说明活泼性M>N;
②M、P用导线连接放入稀盐酸中,M表面有大量气泡,说明P为负极,M为正极,则活泼性P>M;
③电解过程中,阴极存在N2+和E2+两种离子时,E2+优先放电,说明活泼性N>E,则四种金属的活泼性顺序为P M N E,
故选C.
点评 本题考查金属的活泼性的比较,侧重于原电池知识的考查,为高考常见题型和高频考点,注意把握原电池的正极的判断,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
16.有机物燃烧时可能产生一定量的黑烟,下列各组有机物在相同的外界条件下燃烧时,产生的黑烟最浓的一组是( )
| A. | CH3-CH2OH和H2 | B. | CH4和CH3CH2CH3 | ||
| C. | CH2═CH2和CH2═CH-CH3 | D. |  和H-C≡C-H 和H-C≡C-H |
17.利用如图所示装置可以将温室气体CO2转化为燃料气体CO.下列说法中,正确的是( )

| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | 电极a表面发生还原反应 | |
| C. | 该装置工作时,H+从b极区向a极区移动 | |
| D. | 该装置中每生成1 mol CO,同时生成1 mol O2 |
14.下列关于金属铬的叙述中不正确的是( )
| A. | 铬元素在周期表中处于第四周期V IB族 | |
| B. | 铬原子的外围电子层排布为3d44s2 | |
| C. | 铬原子中,质子数为24 | |
| D. | 铬元素位于元素周期表的d区,是过渡元素 |
1.下列存放物质的方法中不正确的是( )
| A. | 金属钠保存在煤油中 | |
| B. | 氢氟酸保存在玻璃试剂瓶中 | |
| C. | 漂白粉必须密封保存 | |
| D. | 氢氧化钠溶液保存在带橡胶塞的试剂瓶中 |
11.下面说法正确的是( )
| A. | CH3CH(CH3)CH(C2H5)CH3的系统命名法的名称为2-甲基-3-乙基丁烷 | |
| B. | 乙炔的结构简式为CHCH,乙烯的球棍模型为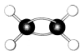 | |
| C. | 己烯和苯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| D. | 向溴乙烷中直接滴加硝酸银溶液,看不到淡黄色沉淀 |
18.下列说法不正确的是( )
| A. | 俄国化学家门捷列夫于1869年发表了第一张元素周期表 | |
| B. | 现代化学常利用原子光谱的特征谱线来测定分子的结构 | |
| C. | DNA双螺旋的两个螺旋链是用氢键相结合的 | |
| D. | 区分晶体和非晶体最可靠的科学方法是X-射线衍射实验 |
15.下列化学用语正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | Na+的结构示意图: | |
| D. | 赤铁矿的主要成分:Fe3O4 |
