题目内容
1.根据如图提供的信息,下列所得结论不正确的是( )
| A. | 该反应为放热反应 | |
| B. | 该反应一定有能量转化成了化学能 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为反应物的总能量低于生成物的总能量,所以该反应需要加热才能发生 |
分析 A.反应物能量低于生成物,反应吸热;
B.生成物能量高,据能量守恒解答;
C.物质的能量越低越稳定;
D.反应热与反应条件无关,决定于反应物和生成物的能量高低.
解答 解:A.反应物能量低于生成物,反应为吸热反应,故A错误;
B.反应物能量比生成物低,一定有能量转化为化学能,故B正确;
C.反应物能量比生成物低,物质的能量越低越稳定,故C正确;
D.大多数吸热反应需要加热,故D错误;
故选AD.
点评 本题考查了化学反应能量变化的分析判断,主要是化学反应实质的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
12.下列物质的分类与对应化学式正确的组是( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | KOH | CH3COOH | Na2CO3 | Al2O3 | SO2 |
| B | NaOH | HCl | NaHCO3 | Na2O | CO |
| C | Ba(OH)2 | H2SO4 | CaCl2 | MgO | CO2 |
| D | Ca(OH)2 | HNO3 | NaCl | Na2O2 | SO3 |
| A. | A | B. | B | C. | C | D. | D |
9.下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
①Na2CO3、NaHCO3、Ca(OH)2 ②NaHCO3、HCl
③NaAlO2、NaHSO4 ④NaOH、AlCl3⑤Na2CO3 HNO3.
①Na2CO3、NaHCO3、Ca(OH)2 ②NaHCO3、HCl
③NaAlO2、NaHSO4 ④NaOH、AlCl3⑤Na2CO3 HNO3.
| A. | ①② | B. | ②③ | C. | ①③④ | D. | ③④⑤ |
16.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2 | |
| B. | 由C(石墨)═C(金刚石);△H=+1.9KJ/mol,可知1mol石墨的总键能比1mol金刚石的总键能大1.9kJ,即金刚石比石墨稳定 | |
| C. | 在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+285.8KJ/mol | |
| D. | 放热及熵增加的反应,一定能自发进行 |
11.常温下,下列溶液中可能大量共存的离子组是( )
| A. | 某中性溶液中:Na+、Fe3+、SO42-、NO3- | |
| B. | 某无色溶液中:K+、Mg2+、ClO-、SO42- Fe2+ | |
| C. | 能使KSCN变红的溶液中:NH4+、Na+、SiO32-、HCO3- | |
| D. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
8.为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
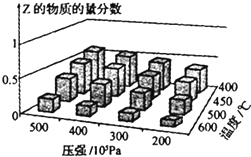

| A. | 在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 | |
| B. | 升高温度,正、逆反应速率都增大,平衡常数增大 | |
| C. | △H>0 m+n>c | |
| D. | 温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
9.常温常压下,既有颜色又有刺激性气味的气体是( )
| A. | CO | B. | SO2 | C. | Cl2 | D. | NH3 |



 过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出实验装置(如图):
过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出实验装置(如图):