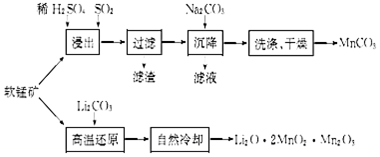
题目内容
5.下列有关气体体积的叙述中,正确的是( )| A. | 一定温度和压强下,各种气体物质体积的大小由构成气体的分子大小决定 | |
| B. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的原子数决定 | |
| C. | 无论外界条件是否相同,不同的气体,若物质的量不同,则它们所含的分子数也不同 | |
| D. | 相同状况下,相同微粒数的Fe、H2O、H2的体积相同 |
分析 A、一定温度和压强下,各种气体物质体积的大小由分子间距离决定;
B、一定温度和压强下,气体摩尔体积一定,气体的体积有气体的物质的量决定;
C.气体体积与温度、压强、气体分子数有关,体积不同,所含分子数不一定不同;
D.在标准状态下,1mol任何气体所占的体积约为22.4L.
解答 解:A、一定温度和压强下,各种气体物质体积的大小由分子间距离决定,故A错误;
B、气体体积=气体的物质的量×气体摩尔体积,在温度和压强一定的条件下,气体摩尔体积一定,气态物质体积的大小,由构成气体的物质的量决定,即气体分子数决定,气体分子可能是单原子分子也可以是多原子分子,故B错误;
C.决定气体的体积因素是温度、压强、气体的分子数,不同气体,若物质的量不同,体积不同,它们所含的分子数不一定不同,故C正确;
D.铁为固体,水为液体,体积取决于过程为本身大小,氢气是气体体积取决于一定温度和压强下气体分子数,相同状况下,相同微粒数的Fe、H2O、H2的体积不相同,故D错误;
故选C.
点评 本题考查了气体体积、气体摩尔体积等知识点,明确气体体积的影响因素、气体摩尔体积的含义是解本题关键,注意:气体摩尔体积受温度和压强影响,为易错点,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
11.某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变成血红色,则下列叙述正确的是( )
①原溶液中的Br-一定被氧化
②通入氯气后原溶液中的Fe2+一定被氧化;
③不能确定通入氯气之后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的Fe2+、Br-、I-均被完全氧化.
①原溶液中的Br-一定被氧化
②通入氯气后原溶液中的Fe2+一定被氧化;
③不能确定通入氯气之后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的Fe2+、Br-、I-均被完全氧化.
| A. | 只有②③ | B. | 只有②③④ | C. | 只有①④ | D. | ①②③④ |
16.下列说法中,正确的是(设阿伏加德罗常数的数值为6.02×1023)( )
| A. | MgCl2 的摩尔质量为95 g | |
| B. | 常温常压下,1 mol CO2的质量是44 g | |
| C. | 标准状况下,1 mol H2O所占的体积约为22.4 L | |
| D. | 100 mL 1mol/L的稀硫酸中含有H+ 的数目约为6.02×1022 |
13.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制.铝在下列使用场合中,不必要加以控制的是( )
| A. | 制造炊具 | B. | 制儿童玩具油漆 | C. | 制牙膏皮 | D. | 炼铝厂制造铝锭 |
20.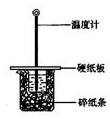 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会无影响
(5)他们记录的实验数据如下:
已知反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.
①计算完成表.
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol.
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会无影响
(5)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
①计算完成表.
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol.
10.下列离子方程式只能表示一个化学反应的是( )
| A. | H++OH -=H2O | |
| B. | Cl -+Ag+=AgCl↓ | |
| C. | Cu 2++2OH -+Ba 2++SO42-=BaSO4↓+Cu(OH)2↓ | |
| D. | H++SO42-+OH-+Ba 2+=BaSO4↓+H2O |
17.用下列试剂和试管中的物质不能完成相应实验目的是( )
| 实验目的 | 试剂 | 试管中的物质 |  | |
| A | 苯环对甲基的影响 | 酸性KMnO4溶液 | ①苯②甲苯 | |
| B | 比较Br-、Fe2+和I-的还原性 | 氯水 | ①FeBr2溶液②FeI2溶液 | |
| C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 | |
| D | 探究接触面积对反应速率的影响 | VmL、cmol/L的盐酸 | ①ag大理石块②ag大理石粉 |
| A. | A | B. | B | C. | C | D. | D |
14.某海域海水一些化学成分如表:
已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,Ksp=1.8×10-11.
某化学小组同学欲用该海水制备MgCl2,并提取Zn.设计流程如图:
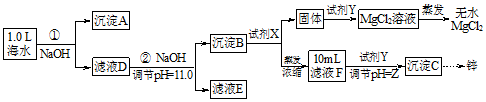
(1)写出生成沉淀A的化学方程式HCO3-+OH-+Ca2+=CaCO3↓+H2O.
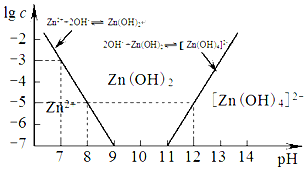
(2)如图为溶液pH与对应的Zn2+、2-物质的量浓度的对数坐标图,结合图中数据,由滤液F到沉淀C过程(一般认为离子浓度低于10-5 mol/L就是沉淀完全),则调节的pH的范围为8<pH<12.
(3)把MgCl2溶液蒸发得到无水MgCl2时,蒸发操作应该在在HCl气氛中环境中进行.
(4)试剂X为NaOH(写化学式).
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
某化学小组同学欲用该海水制备MgCl2,并提取Zn.设计流程如图:

(1)写出生成沉淀A的化学方程式HCO3-+OH-+Ca2+=CaCO3↓+H2O.
(2)如图为溶液pH与对应的Zn2+、2-物质的量浓度的对数坐标图,结合图中数据,由滤液F到沉淀C过程(一般认为离子浓度低于10-5 mol/L就是沉淀完全),则调节的pH的范围为8<pH<12.

(3)把MgCl2溶液蒸发得到无水MgCl2时,蒸发操作应该在在HCl气氛中环境中进行.
(4)试剂X为NaOH(写化学式).