题目内容
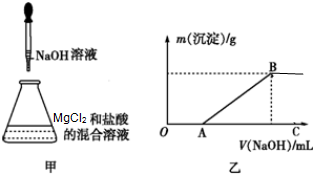 某同学称取一定量的MgCl2固体配成溶液,在该溶液中先加入一定量的稀盐酸,然后逐滴加入NaOH溶液(如图甲所示)
某同学称取一定量的MgCl2固体配成溶液,在该溶液中先加入一定量的稀盐酸,然后逐滴加入NaOH溶液(如图甲所示)滴加过程中生成沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有
a.托盘天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段发生反应的离子方程式为
(3)AB段发生反应的离子方程式为
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是
考点:溶液的配制,离子反应发生的条件
专题:离子反应专题
分析:氯化镁溶液中滴入氢氧化钠,首先发生反应:NaOH+HCl═NaCl+H2O,盐酸反应完毕,再发生反应2NaOH+MgCl2=2NaCl+Mg(OH)2↓,
(1)根据配制一定浓度的溶液的方法选用仪器;
(2)OA段氢氧化钠与氯化氢反应生成氯化钠和水,据此写出反应的离子方程式;
(3)AB段氯化镁与氢氧化钠反应生成氢氧化镁和氯化钠;
(4)B点溶液中的溶质为氯化钠,氯化钠与硝酸银溶液反应生成氯化银沉淀.
(1)根据配制一定浓度的溶液的方法选用仪器;
(2)OA段氢氧化钠与氯化氢反应生成氯化钠和水,据此写出反应的离子方程式;
(3)AB段氯化镁与氢氧化钠反应生成氢氧化镁和氯化钠;
(4)B点溶液中的溶质为氯化钠,氯化钠与硝酸银溶液反应生成氯化银沉淀.
解答:
解:(1)溶解MgCl2固体,应该在烧杯里并且用玻璃棒不断的搅拌,
故答案为:bd;
(2)OA段NaOH与氯化氢反应生成氯化钠和水,反应的离子方程式为:OH-+H+═H2O,
故答案:OH-+H+═H2O;
(3)AB段镁离子与氢氧根离子反应生成氢氧化镁沉淀,反应的离子方程式为:2OH-+Mg2+=Mg(OH)2↓,
故答案:2OH-+Mg2+=Mg(OH)2↓;
(4)根据以上分析B点时镁离子恰好完全沉淀,溶液的只剩NaCl,所以滴加AgNO3溶液,观察到的现象立即出现白色沉淀,反应的离子方程式为:Cl-+Ag+═AgCl↓,
故答案:立即出现白色沉淀;Cl-+Ag+═AgCl↓.
故答案为:bd;
(2)OA段NaOH与氯化氢反应生成氯化钠和水,反应的离子方程式为:OH-+H+═H2O,
故答案:OH-+H+═H2O;
(3)AB段镁离子与氢氧根离子反应生成氢氧化镁沉淀,反应的离子方程式为:2OH-+Mg2+=Mg(OH)2↓,
故答案:2OH-+Mg2+=Mg(OH)2↓;
(4)根据以上分析B点时镁离子恰好完全沉淀,溶液的只剩NaCl,所以滴加AgNO3溶液,观察到的现象立即出现白色沉淀,反应的离子方程式为:Cl-+Ag+═AgCl↓,
故答案:立即出现白色沉淀;Cl-+Ag+═AgCl↓.
点评:本题考查了离子方程式的书写,题目难度不大,试题侧重基础知识的考查,明确常见离子的性质及离子方程式的书写原则为解答关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质溶于水的电离方程式正确的是( )
| A、KHCO3═K++H++CO32- |
| B、H2S═2H++S2- |
| C、KHSO4═K++H++SO42- |
| D、Ba(OH)2=Ba2++(OH)2- |
25℃,弱酸的电离平衡常数Ka如表所示,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
| A、pH相同的三种溶液物质的量浓度关系:c(Na2CO3)>c(NaCN)>c(CH3COONa) |
| B、a L 0.1mol?L-1CH3COOH与b L 0.1mol?L-1NaOH溶液混合后所得溶液中pH>7,则a一定小于或等于b |
| C、物质的量浓度和体积均相同的CH3COONa和NaOH两种溶液,已知前者溶液中离子数目为n1,后者溶液中离子数目为n2,则n1>n2 |
| D、物质的量浓度相同NaHCO3和Na2CO3的混合溶液中:2c(H+)-2c(OH-)=c(CO32-)-c(HCO3-)-c(H2CO3) |
将CO2气体通入下列溶液中,无沉淀生成的是( )
| A、Na2SiO3溶液 |
| B、BaCl2溶液 |
| C、NaAlO2溶液 |
| D、硬脂酸钠溶液 |
只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物.下列物质属于氢化物的是( )
| A、H2CO3 |
| B、H2SO4 |
| C、NaH |
| D、HClO |
铜锌原电池(如图)工作时,下列叙述不正确的是( )
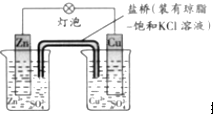

| A、撤掉盐桥不能形成闭合回路,所以不能形成原电池 |
| B、电池反应为Zn+Cu2+═Zn2++Cu |
| C、在外电路中,电子从负极流向正极 |
| D、每生成1molCu,通过盐桥的电子为2mol |
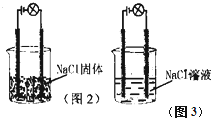 某化学兴趣小组进行化学实验,按照图2连接好线路发现灯泡不亮,按照图3连接好线路发现灯泡亮,由此得出的结论不正确的是( )
某化学兴趣小组进行化学实验,按照图2连接好线路发现灯泡不亮,按照图3连接好线路发现灯泡亮,由此得出的结论不正确的是( )| A、NaCl是电解质 |
| B、NaCl溶液是电解质 |
| C、NaCl在水溶液中电离出可以自由移动的离子 |
| D、NaCl溶液可以导电 |
下列物质都能导电,其中属于电解质的是( )
| A、熔融的NaOH | B、铁丝 |
| C、稀硫酸 | D、NaCl溶液 |
下列事实或现象与胶体性质无关的是( )
| A、一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通道 |
| B、明矾可以用来净水 |
| C、胶态金属氧化物分散于玻璃中制成有色玻璃 |
| D、三氯化铁溶液中加入NaOH溶液出现红褐色沉淀 |