题目内容
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________ ______________________________________。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应方程式: 。
若要确认其中有Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为: 。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
(1)铁表面被钝化
(2)①Fe+2H+=Fe2++H2↑ Fe+ 2Fe3+=3Fe2+ d
②SO2+Br2+2H2O = 2HBr+H2SO4 66.7%
解析试题分析:(1)铁在冷的浓硫酸中钝化,表面生成一层致密的氧化物保护膜,铁与CuSO4溶液被隔离。
(2)①随着反应的进行,硫酸的浓度逐渐减小,变为稀硫酸后,铁与稀硫酸反应生成硫酸亚铁,Fe过量,能与Fe3+反应生成Fe2+,离子方程式为:Fe+2H+=Fe2++H2↑ Fe+ 2Fe3+=3Fe2+;因为溶液含有Fe3+,所以不能用a、b、c项检验Fe2+,可利用Fe2+的还原性,用酸性KMnO4溶液检验Fe2+,故d项正确。
②Br2具有氧化性,SO2具有还原性,发生氧化还原反应,化学方程式为:SO2+Br2+2H2O = 2HBr+H2SO4;2.33g为BaSO4的质量,根据S元素守恒可知:SO2~ BaSO4,n(SO2)=n(BaSO4)=2.33g÷233g/mol=0.01mol,所以SO2的体积分数为:0.01mol×22.4L/mol÷0.336L×100%= 66.7% 。
考点:本题考查物质的性质、方程式的书写、离子的检验,体积分数的计算。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
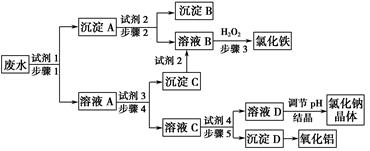
课前课后同步练习系列答案用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。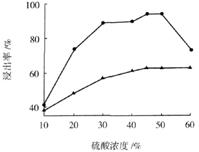

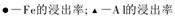
(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)= 。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
| 物质 | Ca(OH)2 | CaSO4 | Na2SO4 |
| 溶解度/g | 0.153 | 0.258 | 19.5 |
结合表中数据,解释步骤III中使用Ca(OH)2而不用NaOH的原因__________。
(7)铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下: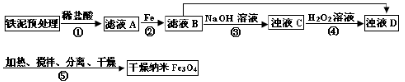
|
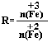 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。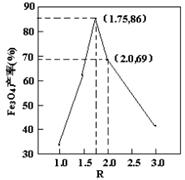
(1)步骤②中,主要反应的离子方程式是______。
(2)已知:Fe3+在pH=2.8时沉淀完全; Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是______。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是______。
(4)下列说法正确的是______(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时,n(FeOOH)/n(Fe2+)="2:1"
d.当n(浊液D中FeOOH)/n(滤液B中的铁元素)=4/7时,Fe3O4的产率最高



 b变化过程的离子方程式 。
b变化过程的离子方程式 。


