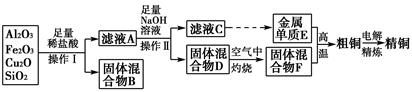
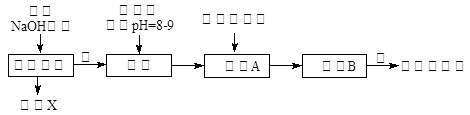题目内容
某厂的酸性工业废水中含有一定量的Na+、Al3+、 Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。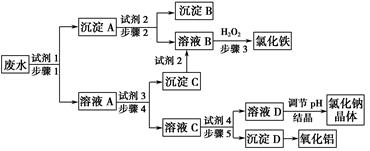
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为_______________________________________。
(4)步骤3反应的离子方程式为_______________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为__________________________________________________________。
(1)废铁屑 稀盐酸
(2)漏斗、玻璃棒、烧杯
(3)Fe+Cu2+=Cu+Fe2+,Fe+2Fe3+=3Fe2+,Fe+2H+=Fe2++H2↑
(4)2Fe2++H2O2+2H+=2Fe3++2H2O
(5)AlO2—+2H2O+CO2=Al(OH)3↓+HCO3—
解析

练习册系列答案
相关题目
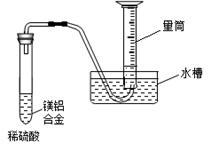
如图是测定铝粉(含镁粉)的纯度的实验装置。所用的NaOH(足量)的物质的量浓度为4.5 mol·L-1。不同时间电子天平的读数如下表所示:
| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 0 | 120 |
| 烧杯+NaOH溶液+样品 | 0 | 135 |
| 1 | 134.5 | |
| 2 | 134.1 | |
| 3 | 133.8 | |
| 4 | 133.8 |
(1)反应中生成气体的质量 g。
(2)试计算样品中铝的质量分数。(写出解题过程)
(3)反应后溶液(溶液的体积变化忽略)的c(OH-)。(写出解题过程)