题目内容
17.为探究固体A的组成和性质,设计实验并完成如图转化.
已知:X由两种化合物组成,若将X通入品红溶液,溶液褪色.若将X通入足量双氧水中,X可全部被吸收且只得到一种强酸,再稀释到1000mL,测得溶液的PH=1.在溶液2中滴加KSCN溶液,溶液呈血红色.请回答:
(1)固体A的化学式FeSO4
(2)写出反应①的化学方程式2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑
(3)写出反应④中生成A的离子方程式2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
分析 X由两种化合物组成,若将X通入品红溶液,溶液褪色,说明X中含SO2,若将X通入足量双氧水中,X可全部被吸收且只得到一种强酸,再稀释到1000mL,测得溶液的PH=1,氢离子浓度为0.1mol/L,生成的硫酸浓度为0.05mol/L,说明X气体中二氧化硫被过氧化氢氧化为硫酸,三氧化硫溶于水生成硫酸,X为SO2、SO3混合气体.在溶液2中滴加KSCN溶液,溶液呈血红色,说明红棕色固体为氧化铁,物质的量=$\frac{4.00g}{160g/mol}$=0.025mol,溶液2为硫酸铁溶液,气体X通过氢氧化钠溶液吸收生成溶液1为硫酸钠、亚硫酸钠,硫酸铁在酸性溶液中氧化亚硫酸根离子为硫酸根离子,硫酸铁被还原为硫酸亚铁,则A为硫酸亚铁,
(1)分析可知A为硫酸亚铁;
(2)反应①是硫酸亚铁分解生成二氧化硫、三氧化硫和氧化铁,结合电子守恒、原子守恒配平书写化学方程式;
(3)反应④中生成A的反应是铁离子氧化亚硫酸根离子生成硫酸.
解答 解:X由两种化合物组成,若将X通入品红溶液,溶液褪色,说明X中含SO2,若将X通入足量双氧水中,X可全部被吸收且只得到一种强酸,再稀释到1000mL,测得溶液的PH=1,氢离子浓度为0.1mol/L,生成的硫酸浓度为0.05mol/L,说明X气体中二氧化硫被过氧化氢氧化为硫酸,三氧化硫溶于水生成硫酸,X为SO2、SO3混合气体.在溶液2中滴加KSCN溶液,溶液呈血红色,说明红棕色固体为氧化铁,物质的量=$\frac{4.00g}{160g/mol}$=0.025mol,溶液2为硫酸铁溶液,气体X通过氢氧化钠溶液吸收生成溶液1为硫酸钠、亚硫酸钠,硫酸铁在酸性溶液中氧化亚硫酸根离子为硫酸根离子,硫酸铁被还原为硫酸亚铁,则A为硫酸亚铁,
(1)分析可知A为硫酸亚铁,化学式为:FeSO4,故答案为:FeSO4 ;
(2)反应①是硫酸亚铁分解生成二氧化硫、三氧化硫和氧化铁,结合电子守恒、原子守恒配平书写化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,
故答案为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(3)反应④中生成A的反应是铁离子氧化亚硫酸根离子生成硫酸,反应的离子方程式为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,
故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
点评 本题考查了物质转化关系的分析判断,主要是物质性质和反应现象、定量关系的理解等,掌握基础是解题关键,题目难度中等.

| A. | 通过酸性KMnO4后再通过澄清石灰水 | |
| B. | 通过Ba(OH)2溶液再通过石灰水 | |
| C. | 直接通过澄清石灰水 | |
| D. | 通过小苏打悬浊液再通过石灰水 |
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:5 |
| A. | 天然气的主要成分是甲烷 | B. | CH3Cl常温下是液体 | ||
| C. | 石油分馏是化学变化 | D. | 钠融法可以测定有机物的结构 |
| A. | HClO | B. | CO2 | C. | Na2CO3 | D. | Ca(OH)2 |
| A. | 9:2 | B. | 3:2 | C. | 3:1 | D. | 1:1 |
| A. | 新制氯水保存在棕色试剂瓶中 | |
| B. | 少量的Na保存在煤油中 | |
| C. | NaOH溶液保存在带橡皮塞的试剂瓶中 | |
| D. | 氢氟酸保存在玻璃试剂瓶中 |
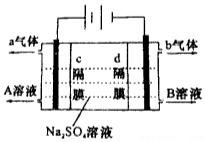 双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是( )
双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是( )| A. | a气体为氢气,b气体为氧气 | |
| B. | A溶液为NaOH,B为H2SO4 | |
| C. | c隔膜为阳离子交换膜、d隔膜为阴离子交换膜 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
| A. | 电子式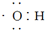 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水杀菌 | |
| D. | 原子结构示意图 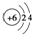 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |