题目内容
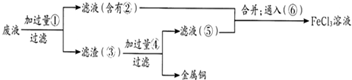
甲、乙、丙、丁四种物质中,甲、乙、丙均含有某种相同的元素,它们之间具有如下转化关系(反应条件和部分产物已略去):甲
乙
丙
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色.
①检验丙溶液中金属阳离子的试剂为 (填试剂名称).
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为 (填代号).
a.3:2b.4:1c.5:1d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是 .
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多.
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为 (填代号)
a.NaOH溶液
b.CaC12溶液
c.稀硫酸
d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
写出OA段所发生反应的离子方程式 ,当加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则盐酸的物质的量浓度为 .

| 丁 |
| 丁 |
| 甲 |
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色.
①检验丙溶液中金属阳离子的试剂为
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为
a.3:2b.4:1c.5:1d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多.
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为
a.NaOH溶液
b.CaC12溶液
c.稀硫酸
d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
写出OA段所发生反应的离子方程式

考点:无机物的推断
专题:
分析:(1)甲、乙、丙均含有某种相同的元素,若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色,即该气体为NO,所以丁为HNO3,根据题中各物质转化关系可知,甲应为有变价的金属元素,所以甲为铁,乙为硝酸铁,丙为硝酸亚铁,据此答题;
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多,则丙为碳酸氢钠,根据题中各物质转化关系可知,甲为氢氧化钠,丁为二氧化碳,乙为碳酸钠,据此答题.
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多,则丙为碳酸氢钠,根据题中各物质转化关系可知,甲为氢氧化钠,丁为二氧化碳,乙为碳酸钠,据此答题.
解答:
解:(1)甲、乙、丙均含有某种相同的元素,若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色,即该气体为NO,所以丁为HNO3,根据题中各物质转化关系可知,甲应为有变价的金属元素,所以甲为铁,乙为硝酸铁,丙为硝酸亚铁,
①丙溶液中金属阳离子为铁离子,铁离子遇KSCN显血红色,遇苯酚出现特殊的紫色,所以检验铁离子试剂为KSCN溶液或苯酚溶液,
故答案为:KSCN溶液或苯酚溶液;
②向含n mol丁的稀溶液中加入m mol单质甲,铁与稀硝酸恰好完全反应除了生成NO外,还可以生成硝酸铁或硝酸亚铁,根据氧化还原反应中电子得失守恒可知,生成硝酸亚铁时铁与硝酸的物质的量之比为3:8,生成硝酸亚铁时铁与硝酸的物质的量之比为1:4,所以n:m的值应介于4:1和8:3之间(含这两个值),
故选bd;
③常温下,浓硝酸溶液能使铁发生钝化现象,所以可存放于铁制作的容器中,
故答案为:常温下,浓硝酸溶液能使铁发生钝化现象;
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多,则丙为碳酸氢钠,根据题中各物质转化关系可知,甲为氢氧化钠,丁为二氧化碳,乙为碳酸钠,
①等浓度的碳酸钠溶液和碳酸氢钠溶液,a.与NaOH溶液均无明显现象;b.与CaC12溶液碳酸钠溶液有沉淀而碳酸氢钠没有;c.与稀硫酸反应产生气体的速率碳酸氢钠快于碳酸钠;d.与澄清石灰水均有沉淀生成,所以鉴别等浓度的碳酸钠溶液和碳酸氢钠溶液,可选用bc,
故答案为:bc;
②将甲、乙、丙三种溶液混合,其中碳酸氢钠会与氢氧化钠反应,所以所得溶液可以是碳酸钠与碳酸氢钠的混合物也可能是碳酸钠与氢氧钠的混合物,或纯碳酸钠溶液,根据向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系图可知,产生气体用去的盐酸体积小于不产生气体用去盐酸的体积,所以可推知混合溶液为碳酸钠与氢氧钠的混合物,OA段为盐酸先与氢氧化钠反应再与碳酸钠反应生成碳酸氢钠,反应的离子方程式为OH-+H+=H2O、CO32-+H+=HCO3-,AB段为碳酸氢钠与盐酸产生二氧化碳,反应的离子方程式为HCO3-+H+=CO2+H2O,当产生气体的体积为22.4mL时,用去盐酸的物质的量为0.001mol,根据图象可知此时产生气体用去的盐酸的体积为35mL-25mL=10mL,所以盐酸的浓度为
=0.1mol/L,
故答案为:OH-+H+=H2O、CO32-+H+=HCO3-;0.1mol/L.
①丙溶液中金属阳离子为铁离子,铁离子遇KSCN显血红色,遇苯酚出现特殊的紫色,所以检验铁离子试剂为KSCN溶液或苯酚溶液,
故答案为:KSCN溶液或苯酚溶液;
②向含n mol丁的稀溶液中加入m mol单质甲,铁与稀硝酸恰好完全反应除了生成NO外,还可以生成硝酸铁或硝酸亚铁,根据氧化还原反应中电子得失守恒可知,生成硝酸亚铁时铁与硝酸的物质的量之比为3:8,生成硝酸亚铁时铁与硝酸的物质的量之比为1:4,所以n:m的值应介于4:1和8:3之间(含这两个值),
故选bd;
③常温下,浓硝酸溶液能使铁发生钝化现象,所以可存放于铁制作的容器中,
故答案为:常温下,浓硝酸溶液能使铁发生钝化现象;
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多,则丙为碳酸氢钠,根据题中各物质转化关系可知,甲为氢氧化钠,丁为二氧化碳,乙为碳酸钠,
①等浓度的碳酸钠溶液和碳酸氢钠溶液,a.与NaOH溶液均无明显现象;b.与CaC12溶液碳酸钠溶液有沉淀而碳酸氢钠没有;c.与稀硫酸反应产生气体的速率碳酸氢钠快于碳酸钠;d.与澄清石灰水均有沉淀生成,所以鉴别等浓度的碳酸钠溶液和碳酸氢钠溶液,可选用bc,
故答案为:bc;
②将甲、乙、丙三种溶液混合,其中碳酸氢钠会与氢氧化钠反应,所以所得溶液可以是碳酸钠与碳酸氢钠的混合物也可能是碳酸钠与氢氧钠的混合物,或纯碳酸钠溶液,根据向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系图可知,产生气体用去的盐酸体积小于不产生气体用去盐酸的体积,所以可推知混合溶液为碳酸钠与氢氧钠的混合物,OA段为盐酸先与氢氧化钠反应再与碳酸钠反应生成碳酸氢钠,反应的离子方程式为OH-+H+=H2O、CO32-+H+=HCO3-,AB段为碳酸氢钠与盐酸产生二氧化碳,反应的离子方程式为HCO3-+H+=CO2+H2O,当产生气体的体积为22.4mL时,用去盐酸的物质的量为0.001mol,根据图象可知此时产生气体用去的盐酸的体积为35mL-25mL=10mL,所以盐酸的浓度为
| 0.001mol |
| 0.01L |
故答案为:OH-+H+=H2O、CO32-+H+=HCO3-;0.1mol/L.
点评:本题考查无机物的推断,为高频考点,综合考查元素化合物知识,把握物质的性质、发生的转化反应为解答的关键,侧重分析与推断能力的考查,题目难度中等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
下列变化过程属于还原反应的是( )
| A、H+→H2O |
| B、Na→Na+ |
| C、CO→CO2 |
| D、Fe3+→Fe2+ |
下列各组烃只要总物质量一定,不论以任何比例混合,完全燃烧时耗氧量相同的是( )
| A、CH4、C2H6 |
| B、C2H4、C3H6 |
| C、C2H2、C6H6 |
| D、C5H10、C6H6 |
下列化合物的分子中,所有原子一定处于同一平面的是( )
| A、乙烷 | B、甲苯 | C、溴苯 | D、苯酚 |
X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g?L-1;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、将X Z2通入W单质与水反应后的溶液中,生成的盐一定只有一种 |
| C、CaX2、CaM2和CaZ2等3种化合物中,阳离子与阴离子个数比为1:2 |
| D、由X、Y、Z、M四种元素共同形成的化合物中一定有共价键可能有离子键 |