题目内容
18.已知四种化合物在水中和液氨中的溶解度如下表:| AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
| H2O(l) | 170g | 9.20g | 1.50×10-4g | 33.3g |
| NH3(l) | 86.0g | 97.2g | 0.80g | 0.00g |
(2)上述四种物质在液氨中发生的复分解反应的化学方程式为Ba(NO3)+2AgCl=2AgNO3+BaCl2↓.
分析 发生复分解反应的条件是生成沉淀、气体或者弱电解质;
(1)在水中,AgCl为难溶物,硝酸银与氯化钡能够发生复分解反应生成氯化银和硝酸钡;
(2)在液氨中,BaCl2为难溶物,氯化银与硝酸钡能够发生复分解反应生成硝酸银和氯化钡.
解答 解:在水中,AgCl为难溶物,硝酸银与氯化钡能够发生复分解反应生成氯化银和硝酸钡,离子方程式:Ag++Cl-═AgCl↓;
故答案为:Ag++Cl-═AgCl↓;
(2)在液氨中,BaCl2为难溶物,氯化银与硝酸钡能够发生复分解反应生成硝酸银和氯化钡,化学方程式:Ba(NO3)2+2AgCl═2AgNO3+BaCl2↓;
故答案为:Ba(NO3)2+2AgCl═2AgNO3+BaCl2↓.
点评 本题考查了化学方程式、离子方程式的书写,明确复分解反应发生的条件是解题关键,题目难度不大.

练习册系列答案
相关题目
9. 某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
试回答下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是上下搅动不能用铜丝搅.拌棒代替环形玻璃棒的理由是铜传热快,防止热量损失.同时为保证实验成功该同学采取了许多措施,如图碎泡沫塑料的作用为隔热,减少热量的损失.
(2)经数据处理,t2-t1=3.4℃盐酸和NaOH溶液的密度按1g•cm-3计算,反应后,混合溶液的比热容按4.18J•g-1•℃-1计算).则该实验测得的中和热△H=-56.8kJ/mol
(3)若将盐酸改为浓硫酸,测得中和热为△H1,则△H1与△H的关系为:△H1<△H (填“<”、“>”或“=”).
(4)倒入NaOH溶液的正确操作是C(填字母).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)上述实验数值结果与57.3kJ mol-1有偏差,产生偏差的原因可能是abc(填字母).
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定酸溶液的温度
c.分多次把NaOH溶液倒人盛有硫酸的小烧杯中.
 某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时用环形玻璃棒搅拌溶液的方法是上下搅动不能用铜丝搅.拌棒代替环形玻璃棒的理由是铜传热快,防止热量损失.同时为保证实验成功该同学采取了许多措施,如图碎泡沫塑料的作用为隔热,减少热量的损失.
(2)经数据处理,t2-t1=3.4℃盐酸和NaOH溶液的密度按1g•cm-3计算,反应后,混合溶液的比热容按4.18J•g-1•℃-1计算).则该实验测得的中和热△H=-56.8kJ/mol
(3)若将盐酸改为浓硫酸,测得中和热为△H1,则△H1与△H的关系为:△H1<△H (填“<”、“>”或“=”).
(4)倒入NaOH溶液的正确操作是C(填字母).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)上述实验数值结果与57.3kJ mol-1有偏差,产生偏差的原因可能是abc(填字母).
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定酸溶液的温度
c.分多次把NaOH溶液倒人盛有硫酸的小烧杯中.
6.按下列实验方法操作,能达到要求的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性的维生素C,可防止该现象发生 | |
| C. | 某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
13.(1)常温下将0.2mol•L-1 HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)>0.2mol•L-1HCl溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②混合溶液中c(Cl-)-c(M+)=9.9×10-7mol•L-1.(填精确计算结果)
(2)常温下若将0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,若溶液的pH不等于7,则混合溶液的pH<7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
①待测NaOH溶液的物质的量浓度为0.1392mol•L-1.(保留四位有效数字)
②下列情况可能引起测定结果偏高的是A C.
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下.
①混合溶液中由水电离出的c(H+)>0.2mol•L-1HCl溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②混合溶液中c(Cl-)-c(M+)=9.9×10-7mol•L-1.(填精确计算结果)
(2)常温下若将0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,若溶液的pH不等于7,则混合溶液的pH<7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1000mol•L-1 HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 20.00 |
| 2 | 25.53 | 20.00 |
| 3 | 27.85 | 20.00 |
②下列情况可能引起测定结果偏高的是A C.
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下.
10.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同.下列判断正确的是( )
| A. | A、C两种元素只能组成化学式为CA3的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F>C>D | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
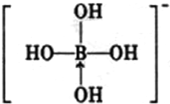 .
.


