题目内容
某研究性学习小组欲探究Na2O2与水反应的实验,查阅资料得知Na2O2与水反应的原理为:2Na2O2+2H2O=4NaOH+O2↑
【实验探究】
(1)根据反应原理可选择下列哪套装置进行实验探究
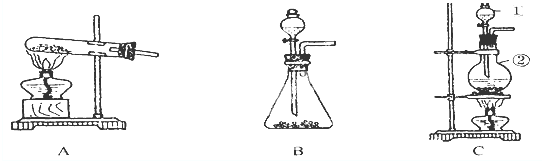
(2)仪器①的名称 仪器②的名称
(3)实验过程中,发现容器外壁发烫,说明该反应是 反应(填“放热”或“吸热”).
反应物Na2O2是 (填“氧化剂”或“还原剂”或“既是氧化剂又是还原剂”)
(4)若要得到22.4L(标况下)的O2,则需要Na2O2的物质的量 mol
(5)往反应后的溶液中滴加CuSO4溶液,产生蓝色的沉淀 (填化学式)
(6)验证有O2生成的方法是
【实验结论】过氧化钠能与水反应,生成氢氧化钠和氧气.
【知识联想】
(7)钠是人体必需的一种常量元素,在剧烈运动或高温作业大量流汗后应及时补充
(8)钠的化合物种类很多,如Na2CO3、NaHCO3、Na2SO4、NaCl等,生活中常用NaHCO3可作为食品
疏松剂的原因是 .
【实验探究】
(1)根据反应原理可选择下列哪套装置进行实验探究

(2)仪器①的名称
(3)实验过程中,发现容器外壁发烫,说明该反应是
反应物Na2O2是
(4)若要得到22.4L(标况下)的O2,则需要Na2O2的物质的量
(5)往反应后的溶液中滴加CuSO4溶液,产生蓝色的沉淀
(6)验证有O2生成的方法是
【实验结论】过氧化钠能与水反应,生成氢氧化钠和氧气.
【知识联想】
(7)钠是人体必需的一种常量元素,在剧烈运动或高温作业大量流汗后应及时补充
(8)钠的化合物种类很多,如Na2CO3、NaHCO3、Na2SO4、NaCl等,生活中常用NaHCO3可作为食品
疏松剂的原因是
考点:碱金属及其化合物的性质实验,钠的重要化合物
专题:几种重要的金属及其化合物
分析:(1)Na2O2与水反应的原理为:2Na2O2+2H2O=4NaOH+O2↑,此反应为固体与液体反应生成气体的反应,常温下即可进行,据此选择仪器即可;
(2)依据实验室常见仪器分析可知:两种仪器分别为:分液漏斗和圆底烧瓶;
(3)仪器外壁发烫,说明反应放热,依据氧化还原反应原理分析过氧化钠的化合价升降判断即可;
(4)依据化学反应方程式:2Na2O2+2H2O=4NaOH+O2↑计算即可;
(5)氢氧化钠与硫酸铜反应生成氢氧化铜,依据化合价书写化学式即可;
(6)依据氧气能使带火星的木条复燃回答;
(7)剧烈运动或高温作业大量流汗人体流失的水分和盐分,据此解答即可;
(8)碳酸氢钠加热分解生成二氧化碳气体和水蒸气,据此解答即可.
(2)依据实验室常见仪器分析可知:两种仪器分别为:分液漏斗和圆底烧瓶;
(3)仪器外壁发烫,说明反应放热,依据氧化还原反应原理分析过氧化钠的化合价升降判断即可;
(4)依据化学反应方程式:2Na2O2+2H2O=4NaOH+O2↑计算即可;
(5)氢氧化钠与硫酸铜反应生成氢氧化铜,依据化合价书写化学式即可;
(6)依据氧气能使带火星的木条复燃回答;
(7)剧烈运动或高温作业大量流汗人体流失的水分和盐分,据此解答即可;
(8)碳酸氢钠加热分解生成二氧化碳气体和水蒸气,据此解答即可.
解答:
解:(1)Na2O2与水反应的原理为:2Na2O2+2H2O=4NaOH+O2↑,此反应为固体与液体反应生成气体的反应,常温下即可进行,故B正确,故答案为:B;
(2)两种仪器分别为:分液漏斗和圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(3)仪器外壁发烫,说明反应放热,在此反应中过氧化钠中O元素部分由-1价升高为0价,部分降低为-2价,故过氧化钠既是氧化剂又是还原剂,故答案为:放热;既是氧化剂又是还原剂;
(4)2Na2O2+2H2O=4NaOH+O2↑
2 22.4L,故答案为:2mol;
(5)氢氧化钠与硫酸铜反应生成氢氧化铜,Cu为+2价,故此沉淀为:Cu(OH)2,故答案为:Cu(OH)2;
(6)氧气能使带火星的木条复燃,故把带火星的木条置于B玻璃管处,若木条复燃,则证明生成氧气,故答案为:把带火星的木条置于B玻璃管处,若木条复燃,则证明生成氧气;
(7)剧烈运动或高温作业大量流汗人体流失的水分和盐分,故需呀补充稀食盐水,故答案为:食盐水;
(8)碳酸氢钠加热分解生成二氧化碳气体和水蒸气,化学反应方程式为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑.
(2)两种仪器分别为:分液漏斗和圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(3)仪器外壁发烫,说明反应放热,在此反应中过氧化钠中O元素部分由-1价升高为0价,部分降低为-2价,故过氧化钠既是氧化剂又是还原剂,故答案为:放热;既是氧化剂又是还原剂;
(4)2Na2O2+2H2O=4NaOH+O2↑
2 22.4L,故答案为:2mol;
(5)氢氧化钠与硫酸铜反应生成氢氧化铜,Cu为+2价,故此沉淀为:Cu(OH)2,故答案为:Cu(OH)2;
(6)氧气能使带火星的木条复燃,故把带火星的木条置于B玻璃管处,若木条复燃,则证明生成氧气,故答案为:把带火星的木条置于B玻璃管处,若木条复燃,则证明生成氧气;
(7)剧烈运动或高温作业大量流汗人体流失的水分和盐分,故需呀补充稀食盐水,故答案为:食盐水;
(8)碳酸氢钠加热分解生成二氧化碳气体和水蒸气,化学反应方程式为:2NaHCO3
| ||
| ||
点评:本题主要考查的是过氧化钠的性质与实验,涉及知识点较多:化学反应方程式、氧化还原反应、氧气的验证等,难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险.由于人体体液的缓冲系统中存在如下平衡:H++HCO3-?H2CO3?CO2+H2O,H++PO43-?HPO42-,H++HPO42-?H2PO4-故能维持血液pH的相对稳定,以保证正常生理活动.下列说法中不合理的是( )
| A、当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定 |
| B、某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒 |
| C、当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定 |
| D、在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小 |
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
| A、由水电离的c(H+):①=②>③=④ |
| B、将①、④两种溶液混合后,若pH=7,则消耗溶液的体积:①>④ |
| C、①②的导电性不同,③④的导电性也不同 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
汽车上的催化转化器,可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-a kJ/mol(a>0),在某温度时,用气体传感器测得不同时间的NO和CO浓度如表:
经分析,得出结论不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A、该反应转化较快,具有存实际意义 |
| B、催化转化器在冬季时对废气转化效率比夏季更高 |
| C、2s末的反应速率v(NO)=3.75×10-4mol?L-1?S1 |
| D、在该温度下,反应的平衡常数K=5000 |
下列物质间的转化不能通过一步化学反应实现的是( )
| A、Fe→FeCl3 |
| B、SiO2→H2SiO3 |
| C、N2→NO |
| D、Na→Na2O2 |
