题目内容
20.下列说法正确的是( )| A. | 过量的铜与浓硝酸反应能产生NO | |
| B. | 将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 | |
| C. | SiO2与所有的酸都不能发生反应 | |
| D. | 加过量盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 |
分析 A、过量的铜与浓硝酸反应,随反应的进行浓硝酸变成稀硝酸,铜与稀硝酸反应生成硝酸铜和一氧化氮;
B、将CO2与Ca(ClO)2溶液中发生复分解反应,而SO2通入Ca(ClO)2溶液发生氧化还原反应;
C、SiO2与氢氟酸反应;
D、产生能使澄清石灰水变浑浊气体可能是二氧化碳和二氧化硫气体.
解答 解:A、过量的铜与浓硝酸反应,随反应的进行浓硝酸变成稀硝酸,铜与稀硝酸反应生成硝酸铜和一氧化氮,所以过量的铜与浓硝酸反应能产生NO,故A正确;
B、将CO2与Ca(ClO)2溶液中发生复分解反应,而SO2通入Ca(ClO)2溶液发生氧化还原反应,则反应的类型不同,故B错误;
C、SiO2与氢氟酸反应,而不是与所有的酸都不能发生反应,故C错误;
D、产生能使澄清石灰水变浑浊气体可能是二氧化碳和二氧化硫气体,所以可能是碳酸氢盐、亚硫酸盐和亚硫酸氢盐,故D错误;
故选A.
点评 本题考查浓硝酸的性质和二氧化硫的还原性,为高频考点,涉及元素及其化合物性质等知识,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.用NA表示阿伏加德罗常数,下列说正确是( )
| A. | 标准状况下,22.4LCC14含有的分子数为NA | |
| B. | 常温常压下,17gNH3所含的原子数目为4NA | |
| C. | 1molNa2O2与H20完全反应,转移2NA个电子 | |
| D. | O.lmol/LNa2CO3溶液中含有的Na+数目为0.2NA |
15.SO42-中存在一种特殊的π键,它是由配位氧原子p轨道上的孤对电子与中心硫原子的空3d轨道发生肩并肩重叠而形成,称为d-pπ键.下列微粒可能含有d-pπ键的是( )
| A. | PO43- | B. | CCl4 | C. | NO3- | D. | SiH4 |
5.工业上可用硫酸铝与硫黄焙烧制备氧化铝,再电解氧化铝制得铝,发生反应如下:
反应Ⅰ:2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2↑,反应Ⅱ:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑
下列说法中正确的是( )
反应Ⅰ:2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2↑,反应Ⅱ:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑
下列说法中正确的是( )
| A. | 反应Ⅰ中S单质是氧化剂 | |
| B. | 反应ⅡAl2O3中Al元素被氧化 | |
| C. | 当生成5.4 g Al时,反应Ⅰ和反应Ⅱ共转移1.2 mol e- | |
| D. | 反应Ⅰ氧化产物与还原产物物质的量之比为2:9 |
12.下列化学反应中,属于氧化还原反应的是( )
| A. | CaCO3═CaO+CO2↑ | B. | NaHCO3+NaOH═Na2CO3+H2O | ||
| C. | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | D. | 3K2MnO4+2H2O═2KMnO4+MnO2↓+4KOH |
9.下列分散系中,分散质粒子直径最小的是( )
| A. | 雾霾 | B. | 乳浊液 | C. | NaCl溶液 | D. | 氢氧化铁胶体 |
10.下列说法不正确的是( )
| A. | 已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g),△H=-285.8 kJ/mol | |
| B. | 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 | |
| C. | 稀氨水中部分粒子的浓度大小关系:c(NH3•H2O)>c(OH-)>c(NH${\;}_{4}^{+}$)>c(H+) | |
| D. | 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)═c(Y-)+c(HY),则HX为强酸 |
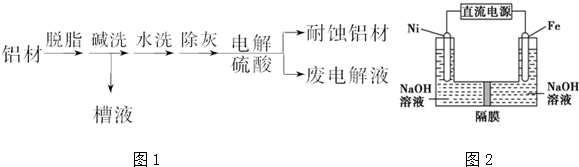
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.