题目内容
12.下列化学反应中,属于氧化还原反应的是( )| A. | CaCO3═CaO+CO2↑ | B. | NaHCO3+NaOH═Na2CO3+H2O | ||
| C. | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | D. | 3K2MnO4+2H2O═2KMnO4+MnO2↓+4KOH |
分析 发生的反应中含元素的化合价变化,则为氧化还原反应,以此来解答.
解答 解:A、B、C中不含元素的化合价变化,为非氧化还原反应,而D中Mn元素的化合价变化,为氧化还原反应,
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
2.硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )

| A. | 电极a为电池负极 | |
| B. | VB2中V的化合价为+4价 | |
| C. | 电子由VB2极经KOH溶液流向a电极 | |
| D. | VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O |
3.下列各项中的两个量,其比值一定为2:1的是( )
| A. | 在Na2SO4溶液中,c(Na+):c(SO42-) | |
| B. | 相同温度下,0.2 mol/L CH3COOH溶液中c(H+)与0.1 mol/LCH3COOH溶液中c(H+) | |
| C. | 在密闭容器中,反应N2(g)+3H2(g)?2NH3 (g)已达平衡时的c(NH3)与c(N2) | |
| D. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液体积 |
20.下列说法正确的是( )
| A. | 过量的铜与浓硝酸反应能产生NO | |
| B. | 将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 | |
| C. | SiO2与所有的酸都不能发生反应 | |
| D. | 加过量盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 |
17.下列四种物质,不能由金属与非金属两种单质直接化合生成的是( )
| A. | FeCl2 | B. | Fe3O4 | C. | Al2O3 | D. | CuCl2 |
1.有5种溶液,他们分别是:①KNO3;②BaCl2;③NaOH;④(NH4)2SO4;⑤CuCl2,若要求不用任何外加试剂鉴别它们,则鉴别的先后顺序正确的是( )
| A. | ⑤④①③② | B. | ⑤③④②① | C. | ②④③①⑤ | D. | ③②④⑤① |
2.下列关于甲、乙、丙、丁四种装置的有关用法,其中不合理的是( )
| A. | 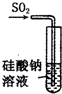 装置:可证明H2SiO3酸性与H2SO3酸性强 | |
| B. |  装置:橡胶管的作用是能使水顺利流下 | |
| C. | 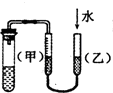 装置:用图示的方法能检查此装置的气密性 | |
| D. | 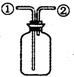 装置:可在瓶中先装入某种液体收集NO气体 |


 分别表示N2、H2、NH3):
分别表示N2、H2、NH3):
 的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,如图是CO2平衡转化率(α) 与氨碳比(x)的关系.
的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,如图是CO2平衡转化率(α) 与氨碳比(x)的关系.
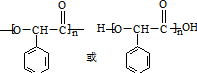
 .
.