题目内容
11.以NA为阿伏加德罗常数,下列说法正确的是( )| A. | 1 mol Cu与含2 mol H2SO4的浓硫酸加热反应,转移的电子数为 2 NA | |
| B. | 5.80g[2 CaSO4.H2O]中含有的H2O分子数为0.04NA(M(2 CaSO4.H2O)=290g.nol-1) | |
| C. | 0.1 mol BaO2与足量的CO2完全反应转移电子数目为0.1NA | |
| D. | 10 mL 5 mol•L-1(NH4)2CO3溶液中含有N原子数目小于0.1 NA |
分析 A.随着反应的进行,浓硫酸浓度逐渐降低,Cu与稀硫酸不反应;
B.n(H2O)=n(CaSO4.H2O)=$\frac{5.8g}{290g/mol}$=0.02mol,以此水分子数为0.02NA;
C.2BaO2+2CO2=2BaCO3+O2↑,BaO2中-1价O一半变为0价一半变为-2价,因此转移电子物质的量等于BaO2的物质的量;
D.根据盐类水解中的物料守恒来分析.
解答 解:A.随着反应的进行,浓硫酸浓度逐渐降低,Cu与稀硫酸不反应,因此转移的电子数小于2 NA,故A错误;
B.n(H2O)=n(CaSO4.H2O)=$\frac{5.8g}{290g/mol}$=0.02mol,以此水分子数为0.02NA,故B错误;
C.2BaO2+2CO2=2BaCO3+O2↑,BaO2中-1价O一半变为0价一半变为-2价,转移电子物质的量等于BaO2的物质的量,因此转移电子数为0.1NA,故C正确;
D.根据盐类水解中的物料守恒可知,铵根离子部分水解为一水合氨,但无论怎么水解,溶液中的氮原子个数恒定,即溶液中的氮原子个数一直为0.1NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算,涉及元素及化合物的性质、氧化还原反应、盐类的水解等知识,综合性较强,C选项是难点,题目难度中等.

练习册系列答案
相关题目
1.下列溶液与100mL 0.5mol•L-1 NaCl溶液中所含Cl-的物质的量浓度相同的是( )
| A. | 100 mL 0.5 mol•L-1MgCl2溶液 | B. | 200 mL 0.25 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1 mol•L-1NaCl溶液 | D. | 25 mL 0.5 mol•L-1HCl溶液 |
2.在下列给定的溶液中一定能大量共存的离子组是( )
| A. | $\frac{{K}_{W}}{C({H}^{+})}$=0.1mol/L的溶液中:K+、Fe2+、Cl?、NO-3 | |
| B. | 水电离的H+浓度为1×10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 加入NH4HCO3固体产生气泡的溶液中:Na+、Mg2+、ClO-、S2- | |
| D. | 加金属铝能产生氢气的溶液中:Ca2+、NH4+、Cl-、HSO3- |
19.下列反应的离子方程式书写正确的是( )
| A. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
6.维生素A对人体特别是对人的视力有重要作用,其结构简式如图所示:

下述关于该化合物的说法正确的是( )

下述关于该化合物的说法正确的是( )
| A. | 维生素A的分子式为C16H25O | B. | 维生素A的一个分子中有3个双键 | ||
| C. | 维生素A含有苯环结构 | D. | 维生素A的分子中含有两种官能团 |
16.25℃四种水溶液①HCl,②FeCl3,③KOH,④Na2CO3其 pH值依次为4、4、10、10,而溶液中水的电离程度大小关系正确的是( )
| A. | ①=②=③=④ | B. | ①=③>②=④ | C. | ④=②>③=① | D. | ①>③>②>④ |
3.在下列物质中,在一定条件下能与某些酸、碱、金属、非金属都反应的是…( )(双选,请举例说明.)
| A. | Al2O3 | B. | H2SO3 | C. | H2S | D. | NaHCO3 |
1.反应3Fe(s)+4H2O(g)?Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加Fe的物质的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入水蒸气 | |
| D. | 压强不变,充入Ne使容器的体积增大 |
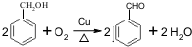 .
. 的化学方程式为
的化学方程式为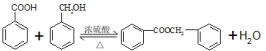 .
.