题目内容
已知:可用如下的氧化还原反应来制备NO2气体,请按要求填写下列空白.
(1)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
①氧化剂是 ,氧化产物是
②将上述化学反应方程式改写成离子反应方程式为:
(2)2H2S+SO2═3S↓+2H2O
①请用双线桥法标出上述化学反应电子转移的方向和数目:
②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为 .
(1)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
①氧化剂是
②将上述化学反应方程式改写成离子反应方程式为:
(2)2H2S+SO2═3S↓+2H2O
①请用双线桥法标出上述化学反应电子转移的方向和数目:
②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为
考点:氧化还原反应的计算,离子方程式的书写,氧化还原反应
专题:氧化还原反应专题
分析:(1)反应中N元素被还原性,HNO3为氧化剂;
(2)反应中H2S中S氧化化合价升高,SO2中S元素化合价降低,结合元素化合价的变化计算.
(2)反应中H2S中S氧化化合价升高,SO2中S元素化合价降低,结合元素化合价的变化计算.
解答:
解:(1)①反应中N元素被还原性,HNO3为氧化剂Cu元素被氧化,Cu(NO3)2为氧化产物,故答案为:HNO3;Cu(NO3)2;
②反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)①反应中H2S中S氧化化合价升高,由-2价升高到0价,SO2中S元素化合价降低,由+4价降低到0价,氧化还原反应反应中得失电子数目相等,表现为化合价升降的总数相等,为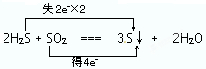 ,故答案为:
,故答案为: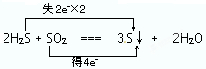 ;
;
②反应2H2S+SO2═3S↓+2H2O中,生成3molS,氧化产物为2mol,生成产物为1mol,转移电子4mol,若氧化产物比还原产物多1.6g,即多0.05mol,则转移电子0.2mol,
电子数为0.2NA,故答案为:0.2NA.
②反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)①反应中H2S中S氧化化合价升高,由-2价升高到0价,SO2中S元素化合价降低,由+4价降低到0价,氧化还原反应反应中得失电子数目相等,表现为化合价升降的总数相等,为
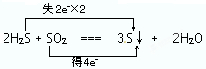 ,故答案为:
,故答案为: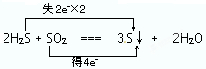 ;
;②反应2H2S+SO2═3S↓+2H2O中,生成3molS,氧化产物为2mol,生成产物为1mol,转移电子4mol,若氧化产物比还原产物多1.6g,即多0.05mol,则转移电子0.2mol,
电子数为0.2NA,故答案为:0.2NA.
点评:本题考查较为综合,全面考查氧化还原反应知识,注意把握元素化合价的变化,明确电子转移的数目和方向,根据化合价的升降总数计算电子转移的数目,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列物质属于天然高分子化合物的是( )
| A、聚乙烯 | B、高级脂肪酸甘油脂 |
| C、蛋白质 | D、葡萄糖 |
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2?L-2,Ksp=1.1×10-10 mol2?L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
| A、BaSO4的溶度积常数比BaCO3的小 |
| B、S没有毒性,C有毒性 |
| C、BaSO4的密度大 |
| D、胃酸能与CO32-结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |
美国一个海军航空站安装了一台250kW的MCFC型燃料电池.该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800℃.已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2.下列推断正确的是( )
| A、正极反应为4OH--4e-═O2↑+2H2O |
| B、放电时,CO32- 向负极移动 |
| C、电池供应1 mol水蒸气,转移的电子的物质的量为4 mol |
| D、放电时CO32-向正极移动 |
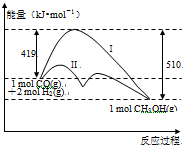 反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A、该反应的△H=+91 kJ/mol |
| B、加入催化剂,该反应的△H变小 |
| C、如果该反应生成液态CH3OH,则△H变大 |
| D、反应物的总能量大于生成物的总能量 |