题目内容
16.下列物质中属于电解质的是( )| A. | 氯化钠溶液 | B. | 金属铜 | C. | 二氧化硫 | D. | 硫酸铜 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,常见的电解质有酸、碱、盐、金属氧化物和水;在水溶液里或熔融状态下都不导电的化合物是非电解质,常见的非电解质有蔗糖、酒精.氨气、非金属氧化物(除了水).
解答 解:A、氯化钠溶液是混合物,故既不是电解质也不是非电解质,故A错误;
B、金属铜是单质,故既不是电解质也不是非电解质,故B错误;
C、二氧化硫是非金属氧化物,溶于水后在溶液生成了亚硫酸导电,和其本身无关,在熔融蔗糖下不导电,故为非电解质,故C错误;
D、硫酸铜在水溶液中能电离出自由移动离子而导电,故为电解质,故D正确.
故选D.
点评 本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.

练习册系列答案
相关题目
6.电解法制取有广泛用途的Na2FeO4,同时获得氢气.工作原理如图1所示,c( Na2FeO4)随初始c(NaOH)的变化如图2.
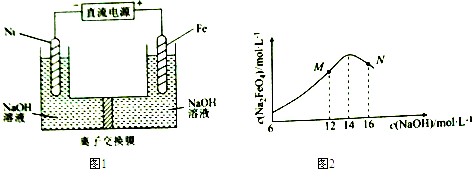
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质.下列说法错误的是( )

已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质.下列说法错误的是( )
| A. | 制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O | |
| B. | 电解过程中,须将阴极产生的气体及时排出 | |
| C. | MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成 | |
| D. | 图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大 |
4.IBr+H2O═HBr+HIO下列关于IBr有关性质的叙述中,正确的是( )
| A. | 与水反应中既是氧化剂又是还原剂 | B. | 与NaOH反应生成溴化钠和次碘酸钠 | ||
| C. | 可作氧化剂 | D. | 与水反应是氧化还原反应 |
11.组成和结构可用  表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 12种 | B. | 28种 | C. | 32种 | D. | 36种 |
1.纯碱(Na2CO3)属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
8.已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体;
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断不正确的是( )
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断不正确的是( )
| A. | 实验③说明KI被氧化 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 实验①证明Cl-具有还原性 | |
| D. | 上述实证明氧化性:ClO3->Cl2>I2 |
17.下列说法正确的是( )
| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 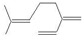 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
 .
.