题目内容
2011年3月,日本福岛核电站发生核泄漏事故.为避免核幅射,需一次性口服100mg的131I,使人体甲状腺中碘达到饱和而不再吸收外界的碘,从而起到保护作用,于是有些人就去抢购碘盐和碘片.下表是某食用碘盐包装袋上的部分说明:
(1)碘元素属于卤族元素,请用电子式表示该元素族中沸点最高的气态氢化物分子的形成过程 ,
(2)下列说法正确的是
A.碘酸钾可氧化氯化钠
B.只用淀粉就能检验碘盐中的碘酸钾
C.高温会导致碘元素的损失:2KIO3
2KI+3O2↑
D.按最大含碘量计算,使人体甲状腺中碘达到饱和,至少需要一次性食用该品牌加碘盐1650g,由知可知仅靠服用加碘食盐是不能起到避免核辐射的作用.
(3)碘酸钾在工业上可用电解法制取.以石墨为阳极,以不锈钢为阴极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI+3H2O
KIO3+3H2↑.则阴极发生的电极反应是 .
(4)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式.
KIO3+ KI+ H2SO4═ K2SO4+ I2+ H2O
(5)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取一定质量的食盐,加适量蒸馏水使其完全溶解配成样品溶液;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液,恰好反应完全.
d.重复操作3次.
若按平均每次操作消耗w g食盐、10.0mL Na2S2O3溶液时行计算,则所测盐中碘元素的含量是(以含w的代数式表示) mg/kg.
| 配 料 | 氯化钠、碘酸钾、抗结剂 |
| 净含量 | 500g |
| 碘含量 | 20~30mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
(2)下列说法正确的是
A.碘酸钾可氧化氯化钠
B.只用淀粉就能检验碘盐中的碘酸钾
C.高温会导致碘元素的损失:2KIO3
| ||
D.按最大含碘量计算,使人体甲状腺中碘达到饱和,至少需要一次性食用该品牌加碘盐1650g,由知可知仅靠服用加碘食盐是不能起到避免核辐射的作用.
(3)碘酸钾在工业上可用电解法制取.以石墨为阳极,以不锈钢为阴极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI+3H2O
| ||
(4)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式.
(5)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取一定质量的食盐,加适量蒸馏水使其完全溶解配成样品溶液;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液,恰好反应完全.
d.重复操作3次.
若按平均每次操作消耗w g食盐、10.0mL Na2S2O3溶液时行计算,则所测盐中碘元素的含量是(以含w的代数式表示)
考点:氯、溴、碘及其化合物的综合应用,氧化还原反应方程式的配平,探究物质的组成或测量物质的含量
专题:实验题,实验探究和数据处理题
分析:(1)卤族元素中,沸点最高的是HF,因为其分子之间存在氢键;
(2)A.碘酸钾中的碘元素处于最高价,具有强的氧化性;
B.碘单质遇到淀粉显示蓝色;
C.高温下碘酸钾会分解,类似于氯酸钾的性质;
D.根据加碘盐中碘元素的含量于人体需要的碘元素含量之间的大小关系来判断;
(3)在电解池的阴极上是电解质中的阳离子发生得电子的还原反应;
(4)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据局电子守恒来配平化学方程式即可;
(5)寻找碘酸根离子、碘单质以及硫代硫酸钠之间的关系来计算盐中碘元素的含量.
(2)A.碘酸钾中的碘元素处于最高价,具有强的氧化性;
B.碘单质遇到淀粉显示蓝色;
C.高温下碘酸钾会分解,类似于氯酸钾的性质;
D.根据加碘盐中碘元素的含量于人体需要的碘元素含量之间的大小关系来判断;
(3)在电解池的阴极上是电解质中的阳离子发生得电子的还原反应;
(4)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据局电子守恒来配平化学方程式即可;
(5)寻找碘酸根离子、碘单质以及硫代硫酸钠之间的关系来计算盐中碘元素的含量.
解答:
解:(1)卤族元素中,沸点最高的是HF,因为HF分子之间存在氢键,分子内部氢原子和氟原子之间存在共价键,形成过程可以表示为 ,
,
故答案为: ;
;
(2)A.碘酸钾中的碘元素处于最高价,不能将氯离子氧化,与NaCl不反应,故A错误;
B.碘单质遇到淀粉显示蓝色,但是碘酸根离子不具有该性质,不能用淀粉检验碘酸钾的存在,故B错误;
C.高温下碘酸钾会分解,2KIO3
2KI+3O2↑,次性质类似于氯酸钾的性质,故C正确;
D.一次食用该品牌加碘盐1650g,是不现实的,所以仅仅靠服用加碘食盐是不能起到避免核辐射的作用,故D正确;
故选CD;
(3)在电解池的阴极上是电解质中的阳离子氢离子发生得电子的还原反应,电极反应为:2H++2e-═H2(或2H2O+2e-═H2+2OH-),
故答案为:2H++2e-═H2(或2H2O+2e-═H2+2OH-);
(4)氧化还原反应中,碘元素化合价升高值=1,碘元素化合价降低值=5,所以应该使得反应转移电子式5mol,根据电子守恒,碘酸钾的系数是1,碘化钾的系数是5,所以碘单质的系数是3,根据原子守恒,硫酸钾前边的系数是3,硫酸的系数是3,水前边系数是3,
故答案为:1;5;3;3;3;3;
(5)根据所发生的化学反应,KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-═2I-+S4O62-,得到碘酸根离子、碘单质以及硫代硫酸钠之间的关系式为:
KIO3~3I2~6S2O32-
1 6
0.01L×2.0×10-3mol?L-1
则碘酸钾中碘元素的含量是
×106×100%=
mg/kg,故答案为:
.
 ,
,故答案为:
 ;
;(2)A.碘酸钾中的碘元素处于最高价,不能将氯离子氧化,与NaCl不反应,故A错误;
B.碘单质遇到淀粉显示蓝色,但是碘酸根离子不具有该性质,不能用淀粉检验碘酸钾的存在,故B错误;
C.高温下碘酸钾会分解,2KIO3
| ||
D.一次食用该品牌加碘盐1650g,是不现实的,所以仅仅靠服用加碘食盐是不能起到避免核辐射的作用,故D正确;
故选CD;
(3)在电解池的阴极上是电解质中的阳离子氢离子发生得电子的还原反应,电极反应为:2H++2e-═H2(或2H2O+2e-═H2+2OH-),
故答案为:2H++2e-═H2(或2H2O+2e-═H2+2OH-);
(4)氧化还原反应中,碘元素化合价升高值=1,碘元素化合价降低值=5,所以应该使得反应转移电子式5mol,根据电子守恒,碘酸钾的系数是1,碘化钾的系数是5,所以碘单质的系数是3,根据原子守恒,硫酸钾前边的系数是3,硫酸的系数是3,水前边系数是3,
故答案为:1;5;3;3;3;3;
(5)根据所发生的化学反应,KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-═2I-+S4O62-,得到碘酸根离子、碘单质以及硫代硫酸钠之间的关系式为:
KIO3~3I2~6S2O32-
1 6
0.01L×2.0×10-3mol?L-1
则碘酸钾中碘元素的含量是
0.01L× 2.0×10-3mol?L-1×
| ||
| wg |
| 1270 |
| 3w |
| 1270 |
| 3w |
点评:本题是一道关于氧化还原反应以及物质的含量的测定的综合考查题,要求学生具有分析和解决问题的能力,综合性强,难度大.

练习册系列答案
相关题目
下列有关实验装置进行的相应实验,能达到实验目的是( )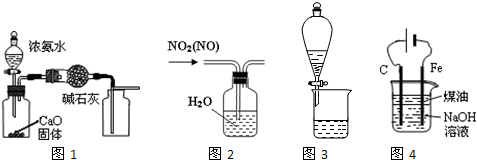

| A、用图1装置制取并收集干燥纯净的NH3 |
| B、用图2所示装置可除去NO2中的NO |
| C、用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D、用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温下,23g NO2含有NA个氧原子 |
| B、25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| C、标准状况下,22.4L H2O中含有的分子数为NA |
| D、2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,32g O2含有的原子数为2NA |
| B、100mL 1mol?L-1氨水中,含有OH-离子数是0.1 NA |
| C、100mL 2 mol?L-1碳酸钠溶液中,CO32-离子数为0.2NA |
| D、标准状况下,22.4LCl2通入足量NaOH溶液,转移的电子数为2NA |
环境污染是人类社会面临的重大威胁,保护环境人人有责.下列对应关系不正确的是( )
| A、二氧化硫--酸雨 |
| B、二氧化碳--温室效应 |
| C、水体富营养化--水华 |
| D、二氧化硅--白色污染 |


 白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等. 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: