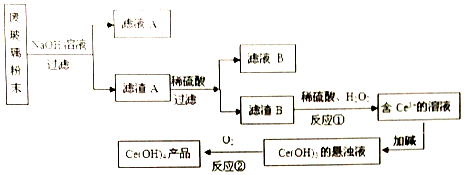
题目内容
5.下列有关电解质溶液的叙述中错误的是( )| A. | 在T°C时,某溶液中c(H+)=$\sqrt{{K}_{W}}$,则该溶液一定显中性 | |
| B. | 25°C时,如弱酸与强碱溶液的pH之和等于14,则它们等体积混合液呈酸性 | |
| C. | 常温下,pH相等的NaOH溶液与氨水稀释后保持pH仍然相等,则氨水加水多 | |
| D. | 体积和pH均相等的HCl与CH3COOH溶液分别与足量锌粒反应,放出H2一样多 |
分析 A、在T°C时,Kw=c(H+)•c(OH-),而c(H+)=$\sqrt{{K}_{W}}$,说明溶液中c(H+)=c(OH-);
B、酸与碱溶液的pH之和等于14,如果碱为强碱,当酸为强酸时,则溶液的pH=7;当酸为弱酸时,酸过量,混合后溶液显酸性,即pH<7,即pH一定不大于7;
C、一水合氨为弱碱存在电离平衡,稀释促进水的电离;
D、等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多.
解答 解:A、在T°C时,Kw=c(H+)•c(OH-),而c(H+)=$\sqrt{{K}_{W}}$,说明溶液中c(H+)=c(OH-),所以溶液呈中性,故A正确;
B、酸与碱溶液的pH之和等于14,如果碱为强碱,当酸为强酸时,则溶液的pH=7;当酸为弱酸时,酸过量,混合后溶液显酸性,即pH<7,即pH一定不大于7,而弱酸与强碱,所以混合反应后溶液呈酸性,故B正确;
C、一水合氨为弱碱存在电离平衡,稀释促进水的电离,将等体积pH均相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大,所以稀释后保持pH仍然相等,则氨水加水多,故C正确;
D、等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多,而不是一样多,故D错误;
故选D.
点评 本题考查弱电解质的电离和盐类的水解知识,题目难度中等,本题注意酸碱性强弱的讨论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.根据下列实验及其现象,所得出的结论正确的是( )
| 实验 | 现象 | 结论 | |
| A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | 非金属性:Cl>C>S |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO32-中的一种或几种 |
| C | 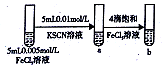 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 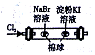 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
13.设NA为阿伏加德罗常数的数值,下列叙述中正确的是( )
| A. | 2mol•L-1 NaCl溶液中含有Na+个数为NA | |
| B. | 标准状况下,22.4 L H2O含有的水分子数为NA | |
| C. | 71g氯气与足最铁粉充分反应,转移的电子数为3NA | |
| D. | 标准状况下,16g O2和O3的混合气体中原子总数为NA |
20.能用共价键键能大小解释的性质是( )
| A. | 稳定性:HCl>HI | B. | 密度:HI>HCl | C. | 沸点:HI>HCl | D. | 还原性:HI>HCl |
17.属于工业固氮的是( )
| A. | N2与O2反应生成NO | B. | 由NH3转变成 NH4HCO3 | ||
| C. | N2与H2在一定条件下反应生成NH3 | D. | 豆科植物的根瘤吸收氮 |
14.短周期主族元素W、X、Y、Z的原子序数依次增大.W、Z同族,Y、Z位于同周期且相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半.下列说法正确的是( )
| A. | W的最高价氧化物是大气污染物之一 | |
| B. | X、Y、Z的离子半径逐渐增大 | |
| C. | X的最高价氧化物的水化物能分别与Y、Z的最高价氧化物对应水化物反应 | |
| D. | 最简单氢化物的热稳定性:Z>W |
15. 变色眼镜的镜片中加有适量的AgBr和CuO.在强太阳光下,因产生较多的Ag而变黑:2AgBr$\frac{\underline{\;CuO\;}}{\;}$ 2Ag+Br2,室内日光灯下镜片几乎呈无色.下列分析错误的是( )
变色眼镜的镜片中加有适量的AgBr和CuO.在强太阳光下,因产生较多的Ag而变黑:2AgBr$\frac{\underline{\;CuO\;}}{\;}$ 2Ag+Br2,室内日光灯下镜片几乎呈无色.下列分析错误的是( )
 变色眼镜的镜片中加有适量的AgBr和CuO.在强太阳光下,因产生较多的Ag而变黑:2AgBr$\frac{\underline{\;CuO\;}}{\;}$ 2Ag+Br2,室内日光灯下镜片几乎呈无色.下列分析错误的是( )
变色眼镜的镜片中加有适量的AgBr和CuO.在强太阳光下,因产生较多的Ag而变黑:2AgBr$\frac{\underline{\;CuO\;}}{\;}$ 2Ag+Br2,室内日光灯下镜片几乎呈无色.下列分析错误的是( )| A. | 强太阳光使平衡右移 | B. | 变色原因能用勒沙特列原理解释 | ||
| C. | 室内日光灯下镜片中无Ag | D. | 强太阳光下镜片中仍有AgBr |