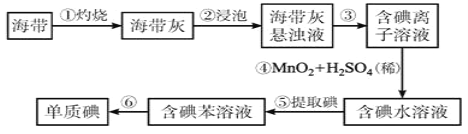
题目内容
【题目】CoCl26H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:
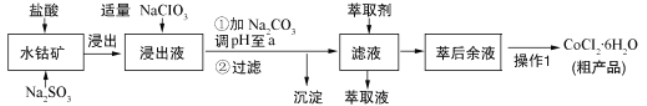
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为________________________。
(2)向浸出液中加入适量NaClO3目的是______________________________________。
(3)“加Na2CO3调pH至a”,a=______;过滤所得沉淀的主要成分为_________(填化学式)。
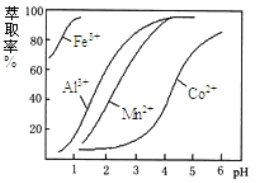
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是__________,使用该萃取剂的最佳pH范围是_____(填选项字母)
A. 5.0﹣5.5 B. 4.0﹣4.5 C. 3.0﹣3.5 D. 2.0﹣2.5
(5)实验操作“操作1”为_______________、_________、过滤和减压烘干;制得的CoCl26H2O在烘干时需减压烘干的原因是________________________。
【答案】 Fe2O3+Na2SO3+4HCl=2FeCl2+Na2SO4+2H2O 将Fe2+氧化为Fe3+,易于除去铁元素 5.2 Fe(OH)3、Al(OH)3 除去溶液中的Mn2+ C; 蒸发浓缩 冷却结晶 降低烘干温度,防止产品分解
【解析】含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,然后过滤,向滤液中加入萃取剂,将锰离子萃取,调节溶液PH在3.0—3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,萃取后的溶液中主要含有CoCl2,为得到CoCl26H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品。(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为Fe2O3+Na2SO3+4HCl=2FeCl2+Na2SO4+2H2O;(2)向浸出液中加入适量NaClO3目的是将Fe2+氧化为Fe3+,易于除去铁元素;(3) “加Na2CO3调pH至a”,a=5.2,保证铝离子沉淀完全,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以沉淀成分为:Fe(OH)3、Al(OH)3;(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;故答案为:除去溶液中的Mn2+;C ;(5)实验操作“操作1”为蒸发浓缩、冷却结晶、过滤和减压烘干;根据CoCl26H2O的组成分析,造成产品中CoCl26H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大或结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案