题目内容
19.(1)在25℃时,若100体积的某强酸溶液与1体积的某强碱溶液混合溶液中性,则混和前强酸pH1和强碱pH2应该满足的关系是pH1+pH2=16(2)某温度(t℃)时,水的离子积Kw=10-12,则该温度(填大于、小于或等于)大于25℃.将此温度下,将pH=2的硫酸溶液V1L与pH=11的氢氧化钠溶液V2L混合:
①若所得混合液为中性,则V1:V2=10:1.
②若所得混合液的pH=10,则V1:V2=9:2.
分析 (1)先设出强酸、强碱的pH值,利用酸碱混合后溶液显中性,则n(H+)=n(OH-),然后可依据物质的量的关系来列式寻找pH的关系;
(2)常温下,水的离子积Kw=1×10-14,水的电离吸热,温度越高,水的电离程度越大;
pH=2的H2SO4溶液中c(H+)=10-2mol/L,pH=11的NaOH溶液中c(OH-)=10-1mol/L,
①若所得混合液为中性,说明酸和碱恰好反应生成盐;
②若所得混合液的pH=10,溶液显碱性,根据混合溶液中氢氧根离子浓度计算酸碱体积之比.
解答 解:(1)设强酸的pH=a,强碱的pH=b,
由25℃时,若100体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,
即n(H+)=n(OH-),
则100×10-a=1×10b-14,102-a=10b-14,即2-a=b-14,则a+b=16,
故pH(酸)+pH(碱)=16,
故答案为:16;
(2)温度越高,水的电离程度越大,则水的离子积常数越大,某温度(t℃)时,水的离子积Kw=1×10-12>10-14,
故答案为:大于;
①pH=2的H2SO4溶液中c(H+)=10-2mol/L,pH=11的NaOH溶液中c(OH-)=10-1mol/L,
若所得混合液为中性,则酸和碱恰好中和,则10-2mol/L×V1L=10-1mol/L×V2L
则V1:V2=10:1;
故答案为:10:1;
②若所得混合液的pH=10,则混合溶液中c(OH-)=10-2mol/L,10-2mol/L=$\frac{1{0}^{-1}×{V}_{2}-1{0}^{-2}×{V}_{1}}{{V}_{1}+{V}_{2}}$mol/L,则Va:Vb=9:2,
故答案为:9:2.
点评 本题考查了pH的有关计算,明确浓度与pH的换算、根据酸碱混合溶液中溶液酸碱性确定酸碱体积之比,题目难度中等,侧重于考查学生的分析能力和计算能力.

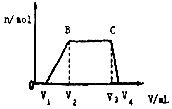 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(2)BC段离子方程式为NH4++OH-═NH3•H2O.
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| N(I-) | a mol | 0 | 0 |
②当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为Cl2+2I-=I2+2Cl-.
③原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
| A. | 往自来水中加入明矾进行杀菌消毒 | |
| B. | 氮化硅陶瓷是一种新型的无机非金属材料 | |
| C. | 在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 为提高农作物的产量和质量,应大量使用化肥和农药 |
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石和氯化钾的熔化 |
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电解后电池中c(KOH)不变;c(Na2CO3)不变 | |
| D. | 电解后电解池中溶液pH变大,且溶液中有晶体析出 |
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,可制备氢氧化铁胶体 | |
| B. | 电泳现象可以证明胶体粒子带电 | |
| C. | 用石膏或盐卤点制豆腐,利用了胶体的吸水性 | |
| D. | 胶体粒子很小,可以透过滤纸和半透膜 |
| A. | 碘 | B. | 铁 | C. | 锌 | D. | 铜 |
 X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )| A. | Q位于第三周期IA族 | |
| B. | X、Y、Z三种元素组成的化合物可能是盐或碱 | |
| C. | 简单离子半径:M->Q+>R2+ | |
| D. | Z与M的最高价氧化物对应水化物均为强酸 |