题目内容
4.H2S溶于水的电离方程式为H2S?H++HS-、HS-?H++S2-.①向H2S溶液中加入CuSO4溶液时,电离平衡向正向(填“正向”或“逆向”,下同)移动,c(H+)增大(填“增大”“减小”或“不变”,下同),c(S2-)减小;
②向H2S溶液中加入NaOH固体时电离平衡向正向移动,c(H+)减小,c(S2-)增大.
分析 H2S为二元弱酸,在溶液存在H2S?H++HS-、HS-?H++S2-,H2S可与硫酸铜反应生成CuS沉淀,可与氢氧化钠反应生成硫化钠,结合浓度对平衡移动的影响解答该题.
解答 解:H2S为二元弱酸,在溶液存在H2S?H++HS-、HS-?H++S2-,故答案为:H2S?H++HS-、HS-?H++S2-;
①当向H2S溶液中加入CuSO4溶液时,Cu2+与S2-结合生成CuS沉淀,硫化氢的电离平衡正移,c(S2-)减小,c(H+) 增大;
故答案为:正向;增大;减小;
②H2S溶液中存在着H2S=H++HS-、HS-=H++S2-的平衡当向H2S溶液中加入NaOH固体时,OH-与H+反应,减少生成物的浓度,平衡向右移动,所以c(H+)减小,c(S2-)增大,
故答案为:正向;减小;增大.
点评 本题考查了弱电解质的电离平衡,加入的物质有些是与其反应而使浓度降低,有些是增加一种离子而使另一种离子浓度降低,也考查了学生的分析问题、解决问题的能力.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
14.下列化合物中含有共价键的离子化合物是( )
| A. | Na2S | B. | CaCl2 | C. | Na2O2 | D. | H2O2 |
19.在一密闭容器内使0.4mol甲烷和适量氯气恰好完全发生取代反应,并生成相同量的四种有机取代物,当恢复到室温时,该容器内的气体的物质的量为(不考虑气体的溶解和液体的蒸发)( )
| A. | 0.1mol | B. | 0.4mol | C. | 1.1mol | D. | 1.6mol |
9.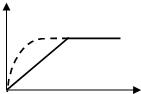 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 增大体积 | C. | 升高温度 | D. | 加大X的投入量 |
16.下列有关化学用语或名称,表达正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: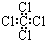 | D. | 乙烯的结构简式:CH2CH2 |
7.对于短周期元素,下列说法正确的是( )
| A. | 若两元素原子序数相差8,则周期数一定相差1 | |
| B. | 两种简单离子不可能相差3个电子层 | |
| C. | 同族的两元素之间不可能形成化合物 | |
| D. | 最外层电子数相同的微粒一定位于同一族 |
8.已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.7×10-13.现有甲、乙两种溶液:甲溶液为1.0×10-2mol/L的AgNO3溶液,乙溶液为1.0×10-2mol/L的NaCl溶液和1.0×10-2mol/L 的NaBr的混合溶液.按以下两种步骤进行实验:①把少量甲溶液滴加到乙溶液中;②把少量乙溶液滴加到甲溶液中.下列说法正确的是( )
| A. | ①可能形成AgBr沉淀 | B. | ①一定能有效分离Cl-与Br- | ||
| C. | ②一定不能形成AgCl沉淀 | D. | ②一定能有效分离Cl-与Br- |
 .
.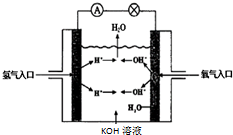 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题: