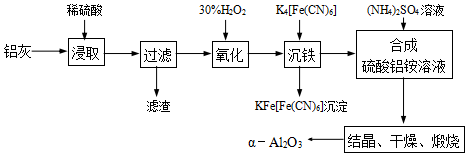
题目内容
9.实验室欲配制100mL 1mol/L的NaNO3溶液,试回答:(1)用不到的仪器是:BC
A.烧杯 B.500mL容量瓶 C.量筒
D.胶头滴管 E.玻璃棒 F.100ml容量瓶
(2)配制时应称取NaNO38.5g
(3)实验开始时,需检查容量瓶是否漏水
(4)下列操作的顺序是(用字母表示)BEAGCDF
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(5)溶液未冷却就转移到了容量瓶中,实验结果将偏大.
分析 (1)配制一定物质的量浓度溶液的步骤选择使用的仪器,然后判断不需要的仪器;
(2)依据m=CVM计算需要溶质的质量;
(3)容量瓶带有瓶塞,使用过程中需要上下颠倒,所以使用前应检查是否漏水;
(4)依据配制一定物质的量浓度溶液的一般步骤解答;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)实验室欲配制100mL 1mol/L的NaNO3溶液,基本步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀等,需要选用的仪器有:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管等,所以不需要.500mL容量瓶、量筒,
故答案为:BC;
(2)配制100mL 1mol/L的NaNO3溶液,需要硝酸钠的质量m=1mol/L×1L×85g/mol=8.5g;
故答案为:8.5;
(3)容量瓶带有瓶塞,使用过程中需要上下颠倒,所以使用前应检查是否漏水;
故答案为:是否漏水;
(4)配制一定物质的量浓度溶液的一般步骤,计算、称量、溶解、移液、洗涤、定容、摇匀,所以正确的操作顺序为:BEAGCDF;
故答案为:BEAGCDF;
(5)溶液未冷却就转移到了容量瓶中,冷却后溶液体积偏小,溶液浓度偏大;
故答案为:偏大.
点评 本题考查了配制一定物质的量浓度的溶液的方法,明确配制原理及操作步骤是解题关键,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,题目难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
1.向氯化铁溶液中加入过量氢氧化钠溶液 震荡后静置一段时间.下列关于该体系的说法中,不正确的是( )
| A. | 生成了氢氧化铁沉淀 | |
| B. | 溶液中不存在Fe3+ | |
| C. | 加入少量盐酸,则溶液中Fe3+浓度会减小 | |
| D. | 体系中存在着氢氧化铁的沉淀溶解平衡 |
14. 某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
 某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )
某研究小组开发出一种人工仿生叶,据称该装置能“吃”进二氧化碳产出生物乙醇.这种装置能够利用太阳能电池板所提供的电力,而系统内的微生物以氢为食,能把空气中的二氧化碳转化为生物燃料.下列说法正确的是( )| A. | 该电池为原电池装置 | |
| B. | a与外接电源正极相连 | |
| C. | a电极的电极反应式为2CO2+6H++12e-═C2H5OH+3H2O | |
| D. | 当a电极上生成1 mol C2H5OH时,b电极上产生标准状况下的气体体积为67.2 L |
1.下列试验中,所选装置不合理的是( )
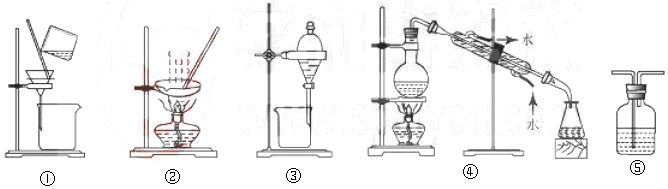

| A. | 粗盐提纯,选①和② | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 用NaOH溶液吸收少量C12选⑤ | D. | 分离Na2CO3溶液和CH3COOC2H5,选④ |
18.下列反应的离子方程式可用H++OH-=H2O表示的有( )
| A. | 醋酸与氢氧化钾溶液 | B. | 氢氧化铜和盐酸 | ||
| C. | 硫酸氢钠与氨水溶液 | D. | 硝酸与氢氧化钡溶液 |
19.图表归纳是学习化学的一种常用方法,某同学归纳的下表与图中对应关系正确的是( )
| 选项 | X | Y | Z |  |
| A | 胶体 | 溶液 | 牛奶 | |
| B | 化合物 | 酸性氧化物 | 三氧化硫 | |
| C | 烃衍生物物 | 卤代烃 | 氯乙酸 | |
| D | 电解质 | 强电解质 | 氟化氢 |
| A. | A | B. | B | C. | C | D. | D |