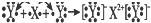题目内容
如表是部分短周期中第二、第三周期元素的原子半径及主要化合价.
回答下列问题:
(1)⑧在元素周期表中的位置是 .
(2)8种元素的最高价氧化物的水化物中,酸性最强的是 (填化学式).
(3)④和⑥形成化合物是 (填化学式);其中含有的化学键类型为 .
(4)下列叙述正确的是 (填序号).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是
(2)8种元素的最高价氧化物的水化物中,酸性最强的是
(3)④和⑥形成化合物是
(4)下列叙述正确的是
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:在第二、三周期元素中,主族元素的最高化合价与其族序数相等,故①③为第ⅠA族,⑤⑦为第ⅤA族,②⑨为第ⅡA族,同一主族元素,原子半径随着原子序数增大而增大,所以在①③中,①是Na元素,③是Li元素,在⑤⑦中,⑤是P元素,⑦是N元素,在②⑨中,、②是Mg元素,⑨是Be元素,④为第ⅢA族,半径小于镁元素大于铍元素,所以④是Al元素,⑥为第ⅤⅡA族,半径小于磷而大于氮,所以⑥是Cl元素,⑧为第ⅥA族,半径小于氮元素,所以⑧是O元素,故①是Na元素、②Mg元素、③是Li元素、④是Al元素、⑤是P元素、⑥是Cl元素、⑦是N元素、⑧是O元素,据此答题.
解答:
解:在第二、三周期元素中,主族元素的最高化合价与其族序数相等,故①③为第ⅠA族,⑤⑦为第ⅤA族,②⑨为第ⅡA族,同一主族元素,原子半径随着原子序数增大而增大,所以在①③中,①是Na元素,③是Li元素,在⑤⑦中,⑤是P元素,⑦是N元素,在②⑨中,、②是Mg元素,⑨是Be元素,④为第ⅢA族,半径小于镁元素大于铍元素,所以④是Al元素,⑥为第ⅤⅡA族,半径小于磷而大于氮,所以⑥是Cl元素,⑧为第ⅥA族,半径小于氮元素,所以⑧是O元素,故①是Na元素、②Mg元素、③是Li元素、④是Al元素、⑤是P元素、⑥是Cl元素、⑦是N元素、⑧是O元素,
(1)⑧是O元素,O原子核外有2个电子层,最外层有6个电子,所以在元素周期表中的位置是第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)非金属的非金属性越强其最高价含氧酸的酸性越强,但氟元素没有含氧酸,所以非金属性次之的是Cl元素,8个元素的最高价氧化物的水化物中,酸性最强的是HClO4,故答案为:HClO4;
(3)④是Al元素、⑥是Cl元素,形成化合物是氯化铝,化学式为Al2Cl6,分子里有配位键和极性键,
故答案为:Al2Cl6;配位键和极性键;
(4)④最高价氧化物对应水化物是氢氧化铝,⑥的氢化物是盐酸,氢氧化铝和盐酸反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(5)A.③是Li元素、④是Al元素,③、④处于不同周期,故正确;
B.②是Mg元素,⑧是O元素,②的阳离子与⑧的阴离子的核外电子数相等,都是10个电子,故正确;
C.⑥是Cl元素,F在其同主族元素中非金属性最强,故错误;
D.⑤是P元素、⑦是N元素,二者位于同一主族,所以⑤元素与⑦元素两者核电荷数之差是8,故正确;
E.①是Na元素、⑧是O元素,①与⑧形成的化合物氧化钠或过氧化钠都没有两性,故错误;
故选:ABD.
(1)⑧是O元素,O原子核外有2个电子层,最外层有6个电子,所以在元素周期表中的位置是第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)非金属的非金属性越强其最高价含氧酸的酸性越强,但氟元素没有含氧酸,所以非金属性次之的是Cl元素,8个元素的最高价氧化物的水化物中,酸性最强的是HClO4,故答案为:HClO4;
(3)④是Al元素、⑥是Cl元素,形成化合物是氯化铝,化学式为Al2Cl6,分子里有配位键和极性键,
故答案为:Al2Cl6;配位键和极性键;
(4)④最高价氧化物对应水化物是氢氧化铝,⑥的氢化物是盐酸,氢氧化铝和盐酸反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(5)A.③是Li元素、④是Al元素,③、④处于不同周期,故正确;
B.②是Mg元素,⑧是O元素,②的阳离子与⑧的阴离子的核外电子数相等,都是10个电子,故正确;
C.⑥是Cl元素,F在其同主族元素中非金属性最强,故错误;
D.⑤是P元素、⑦是N元素,二者位于同一主族,所以⑤元素与⑦元素两者核电荷数之差是8,故正确;
E.①是Na元素、⑧是O元素,①与⑧形成的化合物氧化钠或过氧化钠都没有两性,故错误;
故选:ABD.
点评:本题考查了原子结构和元素周期律的关系,正确推断元素是解本题关键,明确元素周期律的灵活运用,难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
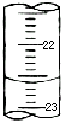
下图分别表示四种操作,其中有两处错误的是( )
A、 读数 |
B、 稀释 |
C、 称量 |
D、 溶解 |
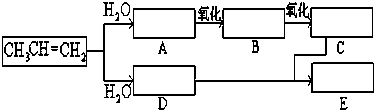
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
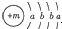 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.