题目内容
20.Al-H2O2电池可用于海上导航.该电池以碱性海水为电解质溶液,用铝和石墨做电极.下列说法正确的是( )| A. | Al是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 海水中的Cl-向正极移动 |
分析 铝、过氧化氢和海水形成原电池,铝做负极发生氧化反应,电极反应式为Al-3e-=Al3+,过氧化氢在正极上发生还原反应,电极反应式为H2O2+2e-═2OH-,原电池中阴离子移向负极,以此解答该题.
解答 解:A.Al具有还原性,易被氧化,应为原电池的负极,故A错误;
B.过氧化氢具有氧化性,应在电极上发生还原反应,故B错误;
C.过氧化氢在正极上发生还原反应,电极反应式为H2O2+2e-═2OH-,溶液的pH增大,故C正确;
D.溶液中Cl-移动方向同外电路电子移动方向一致,应向负极方向移动,故D错误;
故选C.
点评 本题考查原电池的知识,题目难度中等,注意根据物质的性质判断正负极反应以及电极反应式的书写,正确书写电极反应式为解答该题的关键,学习中注意体会书写方法.

练习册系列答案
相关题目
10. 为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
 为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )| A. | N极是负极 | |
| B. | 该装置工作时,H+从右侧经阳离子交换膜移向左侧 | |
| C. | 负极的电极反应为:(C6H10O5)n+7H2O-24ne-═6nCO2↑+24nH+ | |
| D. | 物质X是OH- |
11.强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,向1L1mol•L-1的下列溶液中分别加入1L1mol•L-1的NaOH溶液:①稀醋酸;②稀硫酸;③稀盐酸,完全反应的热效应△H1、△H2、△H3的关系正确的是( )
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △H1=△H3>△H2 | D. | △H2=△H3<△H1 |
8.某香料的合成原料(Y)的分子结构如图,下列有关Y的叙述正确的是( )


| A. | Y的化学式为C9H10O | |
| B. | Y可以发生加成反应和银镜反应 | |
| C. | Y分子中最多有7个碳原子处于同一平面 | |
| D. | Y的同分异构体中,属于芳香烃化合物、且苯环上仅含有一个侧链的醇类物质有5种 |
15.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.
(1)A在周期表位置第一周期第IA族,写出一种工业制备单质F的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应的化学方程式为Cl2+2Na2CO3+H2O═NaClO+NaCl+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为NaH;b的化学式为Na2O2和Na2C2;c的电子式为 ,d是金属晶体
,d是金属晶体
(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为2mol.
(1)A在周期表位置第一周期第IA族,写出一种工业制备单质F的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应的化学方程式为Cl2+2Na2CO3+H2O═NaClO+NaCl+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ,d是金属晶体
,d是金属晶体(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为2mol.
12.钠与水反应的现象与钠的下列性质无关的是( )
| A. | 钠的熔点较低 | B. | 钠的密度小于水 | C. | 钠的硬度较小 | D. | 钠很活泼 |
9.下列说法正确的是( )
| A. | O2和O3互为同位素 | |
| B. | X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为H3XO4 | |
| C. | HCl的形成过程用电子式表示为 | |
| D. | 铝与稀盐酸的反应既是氧化还原反应,又是放热反应 |
10.由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 | 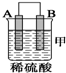 | 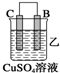 | 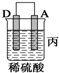 |
| 现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.



 .W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种):
.W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种): 、
、
 为原料制取液晶材料的中间体
为原料制取液晶材料的中间体  的合成路线图.
的合成路线图.