题目内容
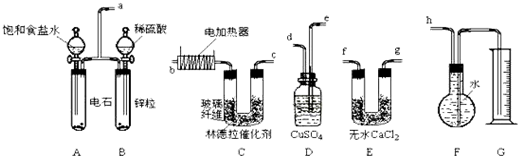
如图是某实验室测定黄铁矿中硫元素的质量分数的装置:实验时有如下操作:
A、将磁管中样品加热到800℃~850℃
B、称取研细的黄铁矿样品
C、连接好全部仪器,并检查其气密性
D、将样品小心放入硬质磁管中部
E、以均匀的速度不断鼓入空气
F、用标准碘溶液滴定含淀粉的SO2水溶液
(1)正确的实验步骤的次序是 (以A、B…的序号表示).
(2)装置①的作用是 ;装置②的作用是 .
(3)碘跟SO2水溶液反应的离子方程式为 .
(4)根据 现象判断滴定已达到终点.
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点 (填“是”或“否”),请说出你的主要理由① ;② .
(6)假定矿样中的硫全部转化为SO2,并全部被水吸收.若称得矿样的质量为0.090g,滴定管中碘溶液的初读数为1.10mL,末读数为25.60mL,标准碘溶液的浓度为0.0500mol?L-1,则该黄铁矿样品中硫元素的质量分数为 .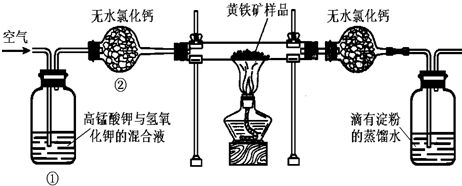
A、将磁管中样品加热到800℃~850℃
B、称取研细的黄铁矿样品
C、连接好全部仪器,并检查其气密性
D、将样品小心放入硬质磁管中部
E、以均匀的速度不断鼓入空气
F、用标准碘溶液滴定含淀粉的SO2水溶液
(1)正确的实验步骤的次序是
(2)装置①的作用是
(3)碘跟SO2水溶液反应的离子方程式为
(4)根据
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点
(6)假定矿样中的硫全部转化为SO2,并全部被水吸收.若称得矿样的质量为0.090g,滴定管中碘溶液的初读数为1.10mL,末读数为25.60mL,标准碘溶液的浓度为0.0500mol?L-1,则该黄铁矿样品中硫元素的质量分数为

考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)依据装置图分析实验过程,是利用空气中的氧气和黄铁矿反应生成二氧化硫,被含有淀粉的水溶液吸收,通过碘单质的溶液滴定到淀粉变蓝计算生成二氧化硫的含量,实验操作为连接装置,检查装置气密性,称取研细的黄铁矿样品,放入硬质试管中部,以均匀的速度不断鼓入空气,并将硬质试管中样品加热反应,用标准碘溶液滴定含淀粉的SO2的水溶液,分析标准写出正确顺序;
(2)装置①中是高锰酸钾溶液与氢氧化钾溶液的混合溶液,目的是为了吸收空气中可能含有的二氧化硫气体;装置②干燥管中的氯化钙是干燥气体的作用;
(3)碘单质具有氧化性,可以氧化二氧化硫为硫酸,碘单质被还原为碘离子,写出反应的离子方程式;
(4)依据滴定实验和反应过程碘单质滴入最后一滴溶液颜色由无色变化为蓝色,证明二氧化硫全部反应;
(5)依据黄铁矿燃烧不完全则生成的二氧化硫偏少以及二氧化硫没充分吸收或部分氧化成三氧化硫来分析;
(6)依据反应I2+SO2+2H2O=4H++SO42-+2I-,计算二氧化硫物质的量,矿样中的硫全部转化为SO2,并全部被水吸收,依据硫元素守恒计算硫元素的质量含量.
(2)装置①中是高锰酸钾溶液与氢氧化钾溶液的混合溶液,目的是为了吸收空气中可能含有的二氧化硫气体;装置②干燥管中的氯化钙是干燥气体的作用;
(3)碘单质具有氧化性,可以氧化二氧化硫为硫酸,碘单质被还原为碘离子,写出反应的离子方程式;
(4)依据滴定实验和反应过程碘单质滴入最后一滴溶液颜色由无色变化为蓝色,证明二氧化硫全部反应;
(5)依据黄铁矿燃烧不完全则生成的二氧化硫偏少以及二氧化硫没充分吸收或部分氧化成三氧化硫来分析;
(6)依据反应I2+SO2+2H2O=4H++SO42-+2I-,计算二氧化硫物质的量,矿样中的硫全部转化为SO2,并全部被水吸收,依据硫元素守恒计算硫元素的质量含量.
解答:
解:(1)装置图实验过程分析可知,是利用空气中的氧气和黄铁矿反应生成二氧化硫,被含有淀粉的水溶液吸收,通过碘单质的溶液滴定到淀粉变蓝计算生成二氧化硫的含量,实验操作为连接装置,检查装置气密性,称取研细的黄铁矿样品,放入硬质试管中部,以均匀的速度不断鼓入空气,并将硬质试管中样品加热反应,用标准碘溶液滴定含淀粉的SO2的水溶液,分析标准写出正确顺序:CBDEAF,
故答案为:CBDAE;
(2)装置①中溶液是高锰酸钾溶液与氢氧化钾溶液的混合溶液,目的是为了吸收空气中可能含有的二氧化硫气体,避免对测定结果产生误差;装置②干燥管中的氯化钙是除去混有的水蒸汽,干燥气体的作用,
故答案为:除去空气中可能含有的SO2等气体;干燥气体;
(3)碘单质具有氧化性,可以氧化二氧化硫为硫酸,碘单质被还原为碘离子,反应的离子方程式为:I2+SO2+2H2O=4H++SO42-+2I-,
故答案为:I2+SO2+2H2O=4H++SO42-+2I-;
(4)利用标准碘单质溶液滴定含淀粉和二氧化硫的无色溶液,碘单质滴入最后一滴溶液颜色由无色变化为蓝色,且半分钟内不褪色,证明二氧化硫全部反应,故答案为:当滴入最后一滴时溶液颜色由无色变为蓝色,且半分钟内不褪色;
(5)因为黄铁矿燃烧不完全则生成的二氧化硫偏少以及二氧化硫没充分吸收或部分氧化成三氧化硫,所以与碘单质反应的二氧化硫偏小,故测出的黄铁矿中硫元素的质量分数通常将偏低;故答案为:是;①黄铁矿燃烧不完全;②二氧化硫没充分吸收或部分氧化成三氧化硫;
(6)若称得矿样的质量为0.0900g,消耗标准碘溶液的体积为25.60-1.10=24.50mL 浓度为0.0500mol?L-1,碘单质物质的量=0.0500mol?L-1×0.02450L=1.225×10-3mol;依据反应定量关系计算;
I2+SO2+2H2O=4H++SO42-+2I-;
1 1
1.225×10-3mol n(SO2)
n(SO2)=1.225×10-3mol
则该黄铁矿样品中硫元素的质量分数=
×100%=43.56%;
故答案为:43.56%;
故答案为:CBDAE;
(2)装置①中溶液是高锰酸钾溶液与氢氧化钾溶液的混合溶液,目的是为了吸收空气中可能含有的二氧化硫气体,避免对测定结果产生误差;装置②干燥管中的氯化钙是除去混有的水蒸汽,干燥气体的作用,
故答案为:除去空气中可能含有的SO2等气体;干燥气体;
(3)碘单质具有氧化性,可以氧化二氧化硫为硫酸,碘单质被还原为碘离子,反应的离子方程式为:I2+SO2+2H2O=4H++SO42-+2I-,
故答案为:I2+SO2+2H2O=4H++SO42-+2I-;
(4)利用标准碘单质溶液滴定含淀粉和二氧化硫的无色溶液,碘单质滴入最后一滴溶液颜色由无色变化为蓝色,且半分钟内不褪色,证明二氧化硫全部反应,故答案为:当滴入最后一滴时溶液颜色由无色变为蓝色,且半分钟内不褪色;
(5)因为黄铁矿燃烧不完全则生成的二氧化硫偏少以及二氧化硫没充分吸收或部分氧化成三氧化硫,所以与碘单质反应的二氧化硫偏小,故测出的黄铁矿中硫元素的质量分数通常将偏低;故答案为:是;①黄铁矿燃烧不完全;②二氧化硫没充分吸收或部分氧化成三氧化硫;
(6)若称得矿样的质量为0.0900g,消耗标准碘溶液的体积为25.60-1.10=24.50mL 浓度为0.0500mol?L-1,碘单质物质的量=0.0500mol?L-1×0.02450L=1.225×10-3mol;依据反应定量关系计算;
I2+SO2+2H2O=4H++SO42-+2I-;
1 1
1.225×10-3mol n(SO2)
n(SO2)=1.225×10-3mol
则该黄铁矿样品中硫元素的质量分数=
| 1.225×10 -3mol×32g/mol |
| 0.09g |
故答案为:43.56%;
点评:本题考查了物质性质的探究实验设计和过程分析判断,滴定实验的过程理解和溶液配制的基本操作步骤应用,物质性质是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
以下说法不正确的是( )
| A、误食重金属盐可立即服用大量的牛奶或豆浆解毒 |
| B、对生活中的塑料垃圾进行填埋,可防止“白色污染” |
| C、食用含铁丰富的食物,可改善贫血症状 |
| D、将碗筷高温蒸煮,可杀菌消毒 |
5℃时,1mol?L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得各溶液的c(NH4+)分别为a、b、c(单位为mol?L-1),下列判断正确的是( )
| A、a=b=c |
| B、a>b>c |
| C、a>c>b |
| D、c>a>b |
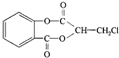 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).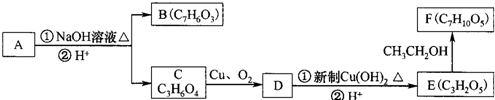
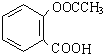 (即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有
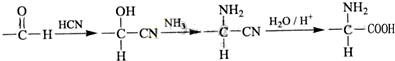
(即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有 )经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
)经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH 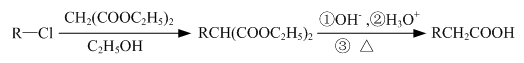
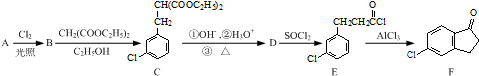
 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: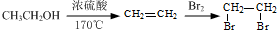
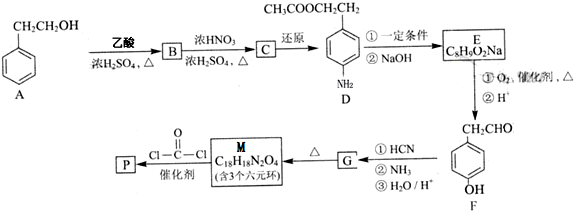
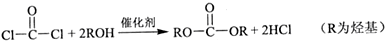

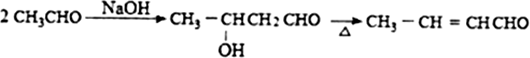
 :苯胺中氨基易被氧化.
:苯胺中氨基易被氧化.