题目内容
19.共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
已知:
R-CH2OH$\stackrel{KMnO_{4}/H+}{→}$R-COOH(R表示饱和烃基)
R-OH+R′-OH$\stackrel{浓硫酸}{→}$R-O-R′+H2O (R、R′表示烃基)
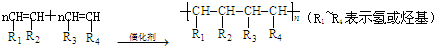
(1)A的结构简式为CH2=CH2.
(2)C的名称为乙二醇.
(3)I由F经①~③合成,F可使溴水褪色
a.①的化学反应方程式是
 .
.b.②的反应试剂是HCl.
c.③的反应类型是氧化反应.
(4)下列说法正确的是acd.
a.C可与水以任意比例混溶 b.A与1,3-丁二烯互为同系物
c.I生成M时,1mol I最多消耗3mol NaOH d.N在一定条件下可发生加聚反应
(5)E与N按照物质的量之比为1:1发生共聚反应生成P,P的结构简式为
 .
.(6)E有多种同分异构体,写出其中一种符合下列条件的异构体的结构简式
 .
.a.分子中只含一种环状结构
b.苯环上有两个取代基
c.1mol该有机物与溴水反应时能消耗4mol Br2.
分析 A和溴发生加成反应生成B,B和氢氧化钠的水溶液发生取代反应生成C,C和苯甲醇反应生成D,从A、B和C中碳原子个数相同,根据D的分子式知,A中含有两个碳原子,则A是CH2=CH2,B是CH2BrCH2Br,C是CH2OHCH2OH,根据题给信息知,D的结构简式为: ,D发生消去反应生成E,则E的结构简式为:
,D发生消去反应生成E,则E的结构简式为: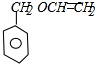 ,根据I的结构简式知,1,3-丁二烯和溴发生1,4加成生成F 1,4-二溴-2-丁烯,1,4-二溴-2-丁烯和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为:HOCH2CH=CHCH2OH,G和氯化氢发生加成反应生成H,H的结构简式为:HOCH2CH2CHClCH2OH,H被酸性高锰酸钾氧化生成I,I和氢氧化钠的醇溶液发生消去反应生成M,M的结构简式为:NaOOCCH=CHCOONa,然后酸化得到N,N的结构简式为:HOOCCH=CHCOOH,E和N反应生成P,则P的结构简式为:
,根据I的结构简式知,1,3-丁二烯和溴发生1,4加成生成F 1,4-二溴-2-丁烯,1,4-二溴-2-丁烯和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为:HOCH2CH=CHCH2OH,G和氯化氢发生加成反应生成H,H的结构简式为:HOCH2CH2CHClCH2OH,H被酸性高锰酸钾氧化生成I,I和氢氧化钠的醇溶液发生消去反应生成M,M的结构简式为:NaOOCCH=CHCOONa,然后酸化得到N,N的结构简式为:HOOCCH=CHCOOH,E和N反应生成P,则P的结构简式为: .
.
解答 解:A和溴发生加成反应生成B,B和氢氧化钠的水溶液发生取代反应生成C,C和苯甲醇反应生成D,从A、B和C中碳原子个数相同,根据D的分子式知,A中含有两个碳原子,则A是CH2=CH2,B是CH2BrCH2Br,C是CH2OHCH2OH,根据题给信息知,D的结构简式为: ,D发生消去反应生成E,则E的结构简式为:
,D发生消去反应生成E,则E的结构简式为: ,根据I的结构简式知,1,3-丁二烯和溴发生1,4加成生成F 1,4-二溴-2-丁烯,1,4-二溴-2-丁烯和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为:HOCH2CH=CHCH2OH,G和氯化氢发生加成反应生成H,H的结构简式为:HOCH2CH2CHClCH2OH,H被酸性高锰酸钾氧化生成I,I和氢氧化钠的醇溶液发生消去反应生成M,M的结构简式为:NaOOCCH=CHCOONa,然后酸化得到N,N的结构简式为:HOOCCH=CHCOOH,E和N反应生成P,则P的结构简式为:
,根据I的结构简式知,1,3-丁二烯和溴发生1,4加成生成F 1,4-二溴-2-丁烯,1,4-二溴-2-丁烯和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为:HOCH2CH=CHCH2OH,G和氯化氢发生加成反应生成H,H的结构简式为:HOCH2CH2CHClCH2OH,H被酸性高锰酸钾氧化生成I,I和氢氧化钠的醇溶液发生消去反应生成M,M的结构简式为:NaOOCCH=CHCOONa,然后酸化得到N,N的结构简式为:HOOCCH=CHCOOH,E和N反应生成P,则P的结构简式为: ;
;
(1)通过以上分析知,A是乙烯,其结构简式为:CH2=CH2,
故答案为:CH2=CH2;
(2)C是乙二醇,
故答案为:乙二醇;
(3)a.①1,4-二溴-2-丁烯和氢氧化钠的水溶液发生取代反应,反应方程式为: ,
,
故答案为: ;
;
b.G和氯化氢发生加成反应生成H,所以②的反应试剂是HCl,
故答案为:HCl;
c.H被酸性高锰酸钾氧化生成I,所以③的反应类型是氧化反应,
故答案为:氧化反应;
(4)a.C是乙二醇,可与水以任意比例混溶,故正确;
b.A是乙烯,乙烯与1,3-丁二烯结构不同,所以不互为同系物,故错误;
c.I生成M时,1mol I最多消耗3mol NaOH,故正确;
d.N的结构简式为:HOOCCH=CHCOOH,在一定条件下可发生加聚反应,故正确;
故选acd;
(5)通过以上分析知,P的结构简式为: ,
,
故答案为: ;
;
(6)E的结构简式为: ,E有多种同分异构体,E的同分异构体符合下列条件:a.分子中只含一种环状结构说明只含苯环,b.苯环上有两个取代基,c.1mol该有机物与溴水反应时能消耗4mol Br2,说明含有一个双键,且苯环上含有酚羟基,苯环上有3类氢原子,则符合条件的E的同分异构体为:
,E有多种同分异构体,E的同分异构体符合下列条件:a.分子中只含一种环状结构说明只含苯环,b.苯环上有两个取代基,c.1mol该有机物与溴水反应时能消耗4mol Br2,说明含有一个双键,且苯环上含有酚羟基,苯环上有3类氢原子,则符合条件的E的同分异构体为: ,
,
故答案为: (其中任一种).
(其中任一种).
点评 本题考查有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,同时考查学生分析推断及知识迁移能力,根据流程图中物质结构简式、反应条件进行推断,难点是推断同分异构体结构简式.

| A. | 标准状况下,22.4LH2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+数为0.02NA | |
| C. | 标准状况下,1NACO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
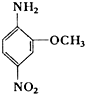 2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )
2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )| A. | 6种 | B. | 7种 | C. | 9种 | D. | 10种 |
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三.
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
定性研究:请你完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体 |
(2)已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1.其它相关数据如下表:
| H2(g) | Cl2 (g) | HCl (g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 243 | a |
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
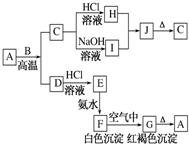 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.