��Ŀ����
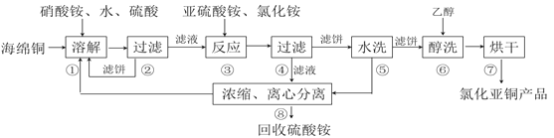
����Ŀ���Ȼ���ͭ��CuCl)�㷺Ӧ���ڻ�����ӡȾ����Ƶ���ҵ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ���ڳ�ʪ��������ˮ���������Ժ���ͭ����Ҫ�ɷ���Cu������CuO��Ϊԭ�ϣ���������������ֽ⼼������CuCl�Ĺ��չ������£�
�ش��������⣺
��1���������еõ�������������_________���ܽ��¶�Ӧ������60~70�ȣ�ԭ����__________��
��2��д������������Ҫ��Ӧ�����ӷ���ʽ___________��
��3��������������pH=2����ϴ��ˮϴ������������ϴ���õ�����_________��д���ƣ���
��4�����������У�����������ʡ�ԣ�������______________________________��
��5����������������������Ҫ���й�Һ���롣��ҵ�ϳ��õĹ�Һ�����豸��__________������ĸ��
A�������� | B�����Ļ� | C����Ӧ�� | D����ʽѹ�˻� |
��6��ȷ��ȡ���Ʊ����Ȼ���ͭ��Ʒm g����������������FeCl3��Һ�У�����Ʒ��ȫ�ܽ��������ϡ���ᣬ��a mol/L��K2Cr2O7��Һ�ζ����յ㣬����K2Cr2O7��Һb mL����Ӧ��Cr2O72-����ԭΪCr3+����Ʒ��CuCl����������Ϊ__________��
���𰸡�CuSO4��Cu2+ �¶ȵ��ܽ��ٶ������¶ȹ�����ηֽ� 2Cu2++SO32-+2Cl-+H2O=2CuCl��+SO42-+2H+ ���� ��ϴ�����ӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������ ��B��D ![]()
��������
��1������ͭ����Ҫ�ɷ���Cu��CuO���ܽ������Լ���������李�ˮ�����ᣬ��Cu������Ϊͭ���ӣ���ϡ��Һ�У������������������������û�������ԣ������Խ��ʣ����Cu2+��NH4+�����ɶ�Ӧ�������Ρ�
��2����������Ӧ����ˣ�˵����Ӧ���г�����������ó���ΪCuCl�������������淋Ļ��գ���֪���������������ӷ�ӦΪ��2Cu2++SO32-+2Cl-+H2O=2CuCl��+SO42-+2H+��
��3�������к��н϶������ӣ������ܽ�CuCl�����������ʣ�������������ԣ�������CuCl�����������ʣ�����ǿ����ֻ��ϡ������ʡ�
��4��CuCl�����ڴ���ˮ����ʪ��������ˮ����������ˮ�봼���ܣ����Դ�ϴ����ʡ�Ե�ԭ���Ǵ��ķе�ͣ��ɼӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ��������Ҳ�����ں���ĺ�ɲ��衣
��5�����ڷ�������Һ����豸��ʵ�����еĹ��˵�ԭ�������Ƶġ�A�������������ڷ��뻥�ܵ�Һ����豸������B�����Ļ�������������������ʹҺ���еĹ���������ﵽ��Һ�����Ŀ�ģ���ȷ��C����Ӧ��Ϊ������Ӧ���豸������D����ʽѹ�˻�����ʹ�����е�ˮͨ����ѹ���ų����ﵽ��Һ�����Ŀ�ģ���ȷ����ѡBD��
��6���������⣬CuCl��K2Cr2O7����������ԭ��Ӧ��K2Cr2O7����ԭΪCr3+����bmL��a mol/L K2Cr2O7��Һ������Ӧʱ��ת�Ƶ��ӵ����ʵ�����ab��10-3��2��3mol=6ab��10-3mol��+1��Cu�ᱻ����ΪCu2+�����ݵ�ʧ�����غ㣬��CuCl�����ʵ�����6ab��10-3mol������Ʒ��CuCl������������(6ab��10-3mol��99.5g/mol)/mg��100%=0.597ab/m��100%��