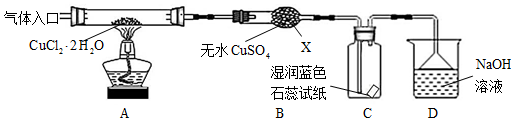
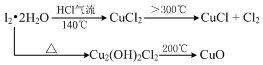题目内容
19.下列离子方程式正确的是( )| A. | 金属钠和水反应:Na+2H2O→Na++2OH-+H2↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O | |
| C. | 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
分析 A.离子方程式两边总电荷不相等,违反了电荷守恒;
B.二氧化硫少量,反应生成亚硫酸钠和水;
C.漏掉了铵根离子与氢氧根离子的反应;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.金属钠和水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.用氢氧化钠溶液吸收少量二氧化硫气体,反应的离子方程式为:SO2+2OH-→=SO32-+H2O,故B正确;
C.向硫酸铵溶液中加入氢氧化钡溶液,反应生成硫酸钡沉淀和一水合氨,在的离子反应为:2NH4++2OH-+Ba2++SO42-═BaSO4↓+2NH3•H2O,故C错误;
D.醋酸和碳酸钙都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
6.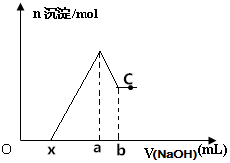 将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
 将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )| A. | C点对应的沉淀为Mg(OH)2 | |
| B. | Al的质量为27(b-a)×10-3 | |
| C. | 该合金与盐酸反应产生的H2为(a-x)×10-3mol | |
| D. | 由图可以确定x的取值范围为:0≤x<(4a-3b) |
10.丙烯醛(结构简式为CH2=CH-CHO)能发生的化学反应有( )
①加成 ②消除(消去) ③取代 ④氧化 ⑤还原 ⑥加聚 ⑦缩聚.
①加成 ②消除(消去) ③取代 ④氧化 ⑤还原 ⑥加聚 ⑦缩聚.
| A. | ①③⑤⑦ | B. | ②④⑥ | C. | ①④⑤⑥ | D. | ③④⑤⑥ |
7.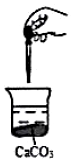 如图,向烧杯中滴加几滴浓盐酸,CaCO3固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )
如图,向烧杯中滴加几滴浓盐酸,CaCO3固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )
 如图,向烧杯中滴加几滴浓盐酸,CaCO3固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )
如图,向烧杯中滴加几滴浓盐酸,CaCO3固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )| A. | c(Ca2+) | B. | c(CO32-) | C. | c(H+) | D. | c(碳酸钙的溶解度) |
14.下列物质的性质可以用“键能”来解释的是( )
| A. | SiO2熔点高 | B. | 氩气性质稳定 | C. | 碘易升华 | D. | NH3极易溶于水 |
11.下列溶液中通入SO2一定不会产生沉淀的是( )
| A. | Ba(OH)2 | B. | Na2S | C. | Ba(NO3)2 | D. | BaCl2 |
8.下列变化过程中,破坏极性共价键的是( )
| A. | 碘的升华 | B. | 硅的熔化 | C. | 食盐电离 | D. | 氯化氢溶于水 |
9.下列过程中,涉及化学变化的是( )
| A. | 用黏土制作陶坯 | B. | 甘油加水作护肤剂 | ||
| C. | 用熟苹果催熟猕猴桃 | D. | 用四氯化碳擦去圆珠笔油渍 |