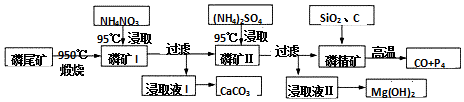
题目内容
4.CuCl广泛应用于化工和印染等行业.某研究性学习小组拟热分解CuCl2•2H2O制备CuCl,并进行相关探究.已知:
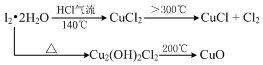
该小组用如图所示装置进行实验(夹持仪器略).请回答下列问题:
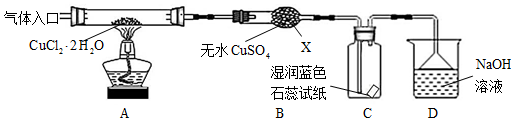
(1)仪器X的名称是球形干燥管.
(2)实验操作的先后顺序是①→③→④→②→⑤.
①检查装置的气密性后加入药品 ②熄灭酒精灯,冷却
③在“气体入口”处通干燥HCl ④点燃酒精灯,加热
⑤停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是石蕊试纸先逐渐变为红色,后褪色.
(4)装置D中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是加热时间不足或温度偏低.
②若杂质是CuO,则产生的原因是通入HCl的量不足.
(6)若m克CuCl2•2H2O全部转化为CuO(铜元素无损耗),则固体质量减少$\frac{91m}{171}$克(用含m的式子表示)
分析 热分解CuCl2•2H2O制备CuCl,为抑制水解,气体入口通入HCl气体,然后加热A处试管,X为球形干燥管,X中无水硫酸铜变蓝,可知CuCl2•2H2O分解生成水,又 大于300℃,发生2CuCl2$\frac{\underline{\;大于300℃\;}}{\;}$2CuCl+Cl2↑,则 产物中还有Cl2,所以C中石蕊试纸先逐渐变为红色,后褪色,D中NaOH溶液吸收尾气;取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,混有CuCl2与温度不够或加热时间不足有关,混有CuO与没有在HCl的氛围中加热或者未等试管冷却就停止通入HCl气体有关,以此来解答.
解答 解:(1)由图及常见的仪器可知,仪器X的名称为球形干燥管,故答案为:球形干燥管;
(2)实验中有气体生成,先检验装置的气密性,且热分解CuCl2•2H2O制备CuCl,防止CuCl被氧化和Cu+水解所以必须要先赶走装置中的氧气和水蒸气后才加热,且要在HCl气流中加热制备,反应结束后先熄灭酒精灯,应该要继续通入氮气直至装置冷切,所以操作顺序为:①-③-④-②-⑤,
故答案为:③-④-②;
(3)B中有白色变为蓝色,说明有水生成,产物中还有Cl2,所以C中石蕊试纸先逐渐变为红色,后褪色,
故答案为:石蕊试纸先逐渐变为红色,后褪色;
(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)①由2CuCl2$\frac{\underline{\;大于300℃\;}}{\;}$2CuCl+Cl2↑,杂质是CuCl2说明CuCl2没有反应完全,分解温度不高,故答案为:加热时间不足或温度偏低;
②杂质是氧化铜,说明CuCl被氧气氧化才产生了CuO,说明装置中有氧气,可能是没有在HCl的氛围中加热或者未等试管冷却就停止通入HCl气体,故答案为:通入HCl的量不足;
(6)若m克CuCl2•2H2O全部转化为CuO(铜元素无损耗),根据铜原子守恒,则固体质量减少m-$\frac{m}{171}$×80=$\frac{91m}{171}$,故答案为:$\frac{91m}{171}$.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、实验装置的作用、元素化合物知识为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验相结合的训练,(5)为解答的难点,题目难度中等.

| A. | 共价键和离子键 | B. | 离子键 | C. | 离子键和金属键 | D. | 共价键 |
| A. | CH4的比例模型 | B. | 二氧化碳的结构式 O-C-O | ||
| C. | S2-的结构示意图  | D. | 氯化钠的电子式  |
| A. | 金属钠和水反应:Na+2H2O→Na++2OH-+H2↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O | |
| C. | 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
| A. | 量筒 | B. | 滴定管 | C. | 50mL容量瓶 | D. | 100mL容量瓶 |
| A. | 滴定管、容量瓶和分液漏斗使用前都要检漏、干燥 | |
| B. | 滴定管没有用标准液润洗,会导致测定结果偏高 | |
| C. | 滴定管中加标准液后,要调节液面位置在零刻度或以下 | |
| D. | 胆矾结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅 |
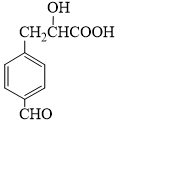
| A. | 能发生缩聚反应 | B. | 能发生消去反应 | ||
| C. | 1mol X最多消耗5 mol H2 | D. | 1mol X最多消耗2 mol Na |
| A. | 20 g D2O 含有的质子数为10NA | |
| B. | 1mol Na2O2与足量水反应转移的电子数为NA,生成的气体在标况下的体积为22.4L | |
| C. | 1L 0.1mol/L HF溶液中含有共价键数目为0.1 NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |