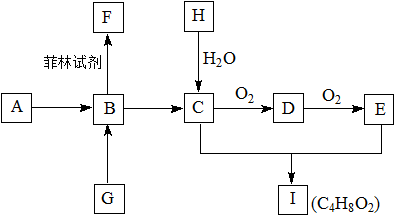
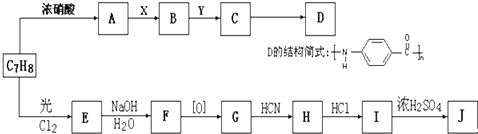
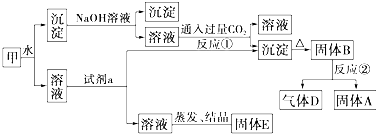
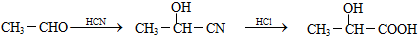题目内容
Na2S2O3?5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20℃和70℃时的溶解度分别为60.0g 和212g,Na2S2O3?5H2O于40~45℃熔化,48℃分解.下面是实验室制备及相关性质实脸.
制备海波的反应原理:Na2SO3+S
Na2S2O3
制备海波的流程:
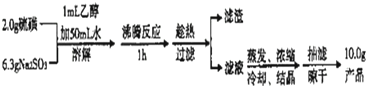
(1)实验开始时用lmL乙醇润湿硫粉的作用是:
A.有利于亚硫酸钠与硫磺的充分接触 B.防止亚硫酸钠溶解
C.控制溶液的pH D.提高产品的纯度
(2)趁热过滤的原因是: .
(3)滤液不采用直接蒸发发结晶的可能原因是:
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是:
A.无水乙醇 B.饱和NaCl溶液 C,水 D.滤掖
(5)产品的纯度测定:取所得产品10.0g,配成500mL溶液,再从中取出25mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗20mL 标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6产品的中Na2S2O3?5H2O的纯度为 %
制备海波的反应原理:Na2SO3+S
| ||
制备海波的流程:

(1)实验开始时用lmL乙醇润湿硫粉的作用是:
A.有利于亚硫酸钠与硫磺的充分接触 B.防止亚硫酸钠溶解
C.控制溶液的pH D.提高产品的纯度
(2)趁热过滤的原因是:
(3)滤液不采用直接蒸发发结晶的可能原因是:
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是:
A.无水乙醇 B.饱和NaCl溶液 C,水 D.滤掖
(5)产品的纯度测定:取所得产品10.0g,配成500mL溶液,再从中取出25mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗20mL 标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6产品的中Na2S2O3?5H2O的纯度为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:实验室制备海波的流程:S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触,沸腾反应1小时葱粉反应,Na2SO3+S
Na2S2O3,防止温度降低而使Na2S2O3晶体析出,趁热过滤,因Na2S2O3?5H2O含结晶水,防止直接蒸发结晶使Na2S2O3?5H2O熔化、分解,通过蒸发、冷却、浓缩、结晶、抽滤、晾干得到“海波”Na2S2O3?5H2O;
(1)S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触;
(2)温度降低,Na2S2O3的溶解度会减小
(3)由于Na2S2O3?5H2O在40~45℃熔化,48℃分解,直接蒸发结晶,会使产物融化、分解,得不到Na2S2O3?5H2O;
(4)利用Na2S2O3易溶于水,难溶于醇,选择无水乙醇可以降低硫代硫酸钠的损失;
(5)找出关系式 I2~2Na2S2O3求出25mL溶液中含有的Na2S2O3,n(Na2S2O3)=2×n(I2);
| ||
(1)S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触;
(2)温度降低,Na2S2O3的溶解度会减小
(3)由于Na2S2O3?5H2O在40~45℃熔化,48℃分解,直接蒸发结晶,会使产物融化、分解,得不到Na2S2O3?5H2O;
(4)利用Na2S2O3易溶于水,难溶于醇,选择无水乙醇可以降低硫代硫酸钠的损失;
(5)找出关系式 I2~2Na2S2O3求出25mL溶液中含有的Na2S2O3,n(Na2S2O3)=2×n(I2);
解答:
解:实验室制备海波的流程:S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触,沸腾反应1小时葱粉反应,Na2SO3+S
Na2S2O3,防止温度降低而使Na2S2O3晶体析出,趁热过滤,因Na2S2O3?5H2O含结晶水,防止直接蒸发结晶使Na2S2O3?5H2O熔化、分解,通过蒸发、冷却、浓缩、结晶、抽滤、晾干得到“海波”Na2S2O3?5H2O.
(1)由于S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触,故答案为:A;
(2)若温度降低,Na2S2O3的溶解度会减小,导致Na2S2O3的晶体析出,最后得到的Na2S2O3减少,
故答案为:防止温度降低而使Na2S2O3晶体析出;
(3)由于Na2S2O3?5H2O于40~45℃熔化,48℃分解,若直接蒸发结晶,会使产物融化、分解,得不到Na2S2O3?5H2O,
故答案为:直接蒸发结晶易使Na2S2O3?5H2O熔化、分解;
(4)由于Na2S2O3易溶于水,难溶于醇,选择无水乙醇可以降低硫代硫酸钠的损失,
故答案为:A;
(5)由I2+2Na2S2O3=2NaI+Na2S4O6可知关系式 I2~2Na2S2O3,25mL溶液中含有的Na2S2O3,n(Na2S2O3?5H2O)=2×n(I2)=2×0.05×0.02mol=0.0002mol,配成的500mL溶液中的n(Na2S2O3?5H2O)=0.002×20mol=0.04mol,m(Na2S2O3?5H2O)=0.04×248=9.92g,
产品的中Na2S2O3?5H2O的纯度为:
×100%=99.2%,
故答案为:99.2%;
| ||
(1)由于S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触,故答案为:A;
(2)若温度降低,Na2S2O3的溶解度会减小,导致Na2S2O3的晶体析出,最后得到的Na2S2O3减少,
故答案为:防止温度降低而使Na2S2O3晶体析出;
(3)由于Na2S2O3?5H2O于40~45℃熔化,48℃分解,若直接蒸发结晶,会使产物融化、分解,得不到Na2S2O3?5H2O,
故答案为:直接蒸发结晶易使Na2S2O3?5H2O熔化、分解;
(4)由于Na2S2O3易溶于水,难溶于醇,选择无水乙醇可以降低硫代硫酸钠的损失,
故答案为:A;
(5)由I2+2Na2S2O3=2NaI+Na2S4O6可知关系式 I2~2Na2S2O3,25mL溶液中含有的Na2S2O3,n(Na2S2O3?5H2O)=2×n(I2)=2×0.05×0.02mol=0.0002mol,配成的500mL溶液中的n(Na2S2O3?5H2O)=0.002×20mol=0.04mol,m(Na2S2O3?5H2O)=0.04×248=9.92g,
产品的中Na2S2O3?5H2O的纯度为:
| 9.92 |
| 10 |
故答案为:99.2%;
点评:本题以实验室制备Na2S2O3?5H2O为载体,考查学生的阅读、分析、理解信息的能力,侧重考查了硫及其化合物的性质,注意(5)利用I2~2Na2S2O3关系式计算,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、22.4 L O2中含有氧分子的个数为2NA |
| B、24g Mg与足量氧气反应转移的电子数为2NA |
| C、28g N2中含有氮原子的个数为NA |
| D、1L 1 mol?L-1MgCl2溶液中含有氯离子个数为NA |
X、Y、Z三种短周期非金属元素在元素周期表中的位置如图所示,下列说法正确的是( )
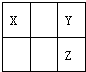

| A、原子的半径:Y大于X |
| B、氢化物的稳定性:X大于Y |
| C、最高价氧化物水化物的酸性:Z强于Y |
| D、Z原子比Y原子多一个电子层 |