题目内容
5.孔雀石的主要成分是Cu(OH)2•CuCO3 (其杂质主要为FeCO3等),它用于制于胆矾的实验步骤如下:①在100mL烧杯中加入3mol•L-1稀硫酸12mL,加热,少量多次加入5~10g孔雀石粉,控制硫酸铜溶液的pH约为1.5~2.0,并加水稀释至35mL左右.
②滴加约4mL 3% H2O2,待滴加完后,用2mol•L-1 NaOH溶液调节溶液的酸度,控制pH值为3.0~3.5,将溶液加热至沸数分钟,趁热过滤.
③水浴加热,蒸发结晶
④重结晶
试回答下列问题:
(1)步骤①中为什么要少量多次加入孔雀石粉?原料中Cu(OH)2•CuCO3的含量未知,少量多次加可以使两者接近于完全反应,避免其中一种过量太多,可以控制合适的pH值,减少后续过程氢氧化钠的加入量,从而减少杂质的引入;用硫酸浸取的化学方程式:Cu(OH)2•CuCO3+2H2SO4=2CuSO4+3H2O+CO2↑.
(2)pH值控制为3.0~3.5,其目的是:使Fe3+沉淀完全,而Cu2+仍留在母液中
(3)为什么必须水浴加热及怎样判断蒸发浓缩已完成:因温度高时,CuSO4•5H2O会失去结晶水,当液面出现较多晶膜时即可说明蒸发浓缩已完成.
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重计录如下表:

写出212-250℃温度范围内发生反应的化学方程式:CuSO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O.
分析 (1)孔雀石的主要成分是Cu(OH)2•CuCO3 (其杂质主要为FeCO3等),制胆矾时要尽可能使硫酸与孔雀石恰好完全反应,减少杂质的引入;
(2)酸浸后溶液中有Fe3+、Cu2+,通过控制pH值除去Fe3+;
(3)温度高时,CuSO4•5H2O会失去结晶水,所以蒸发浓缩时温度不能太高,当液面出现较多晶膜时即可说明蒸发浓缩已完成;
(4)由图象中物质的变化情况分析硫酸铜晶体分解的最低温度,依据212-250℃温度范围内固体物质的质量数据进行分析即可,依据信息中关于反应的叙述书写方程式即可.
解答 解:(1)孔雀石的主要成分是Cu(OH)2•CuCO3 (其杂质主要为FeCO3等),制胆矾时要尽可能使硫酸与孔雀石恰好完全反应,减少杂质的引入,因为原料中Cu(OH)2•CuCO3的含量未知,少量多次加可以使两者接近于完全反应,避免其中一种过量太多,可以控制合适的pH值,减少后续过程氢氧化钠的加入量,从而减少杂质的引入,酸溶的反应方程式为Cu(OH)2•CuCO3+2H2SO4=2CuSO4+3H2O+CO2↑,
故答案为:原料中Cu(OH)2•CuCO3的含量未知,少量多次加可以使两者接近于完全反应,避免其中一种过量太多;可以控制合适的pH值,减少后续过程氢氧化钠的加入量,从而减少杂质的引入;Cu(OH)2•CuCO3+2H2SO4=2CuSO4+3H2O+CO2↑;
(2)酸浸后溶液中有Fe3+、Cu2+,通过控制pH值除去Fe3+,所以pH值控制为3.0~3.5,
故答案为:使Fe3+沉淀完全,而Cu2+仍留在母液中;
(3)温度高时,CuSO4•5H2O会失去结晶水,所以蒸发浓缩时温度不能太高,当液面出现较多晶膜时即可说明蒸发浓缩已完成,
故答案为:因温度高时,CuSO4•5H2O会失去结晶水,当液面出现较多晶膜时即可说明蒸发浓缩已完成;
(4)由图分析可知,CuSO4•5H2O受热到45℃时开始脱水分解,212℃时可得到较稳定的一种中间物,在212℃时失去的水的质量为0.375g-0.267g=0.108g,根据反应的化学方程式:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
0.375g 0.108g
解得n=4,212℃时可得到较稳定的一种中间物为CuSO4•H2O
248℃时可得到较稳定的一种中间物,根据反应的化学方程式:
CuSO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(1-n)H2O+nH2O
178 18n
0.267g 0.267g-0.240g=0.027g
解得n=1,248℃时可得到较稳定的一种中间物为CuSO4,212-250℃温度范围内发生反应的化学方程式为CuSO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O,
故答案为:CuSO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O.
点评 本题考查常见金属的单质及其化合物的应用和硫酸铜结晶水含量的测定,掌握物质的制取和提纯、离子的检验等实验操作,分析图象信息是完成本题目的关键,题目较为综合,难度中等.

 阶梯计算系列答案
阶梯计算系列答案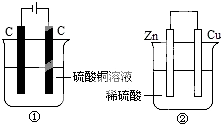 如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | ②中负极:2H++2e-═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 , (反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图12,则总反应的△H 0,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。

②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由: 。
③下列措施中有利于提高aHCl的有 。
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7] | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位)。
为探讨反应X+Y Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反
Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反 应速率的判断正确的是( )
应速率的判断正确的是( )
c(X) | c(Y) | 所需时间(秒) |
0.10 | 0.10 | 0.60s |
0.20 | 0.10 | 0.15s |
0.20 | 0.05 | 0.30s |
A.与c(X)成正比且与c(Y)成正比
B.与c(X)成正比且与c(Y)无关
C.与c2(X)成正比且与c(Y)成正比
D.与c2(X)成正比且与c(Y)成反比
| A. | 稀释溶液,c(CO32-)/c(OH-) 增大 | |
| B. | 升高温度,c(CO32-)/c(HCO3-)增大 | |
| C. | 溶液中存在:c(Na+)+c(H+)═c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | 完全吸收0.1molCO2气体后,溶液中存在:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | 能发生丁达尔效应 | B. | 用FeCl3和烧碱溶液反应制备 | ||
| C. | 微粒直径在1nm-100nm之间 | D. | 能透过滤纸 |
 2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( ) 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标