题目内容
12.硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量.
反应原理:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250mL容量瓶(填仪器名称).
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是A.
A.稀硫酸 B.浓硝酸 C.稀硝酸 D.稀盐酸
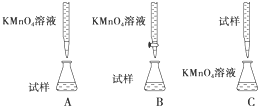
(3)某同学设计的下列滴定方式中,最合理的是B(夹持部分略去)(填字母序号)如图.
方案二 重量法 操作流程如下:
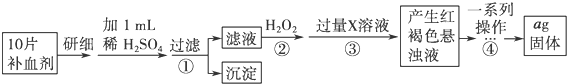
(4)步骤②是否可以省略不能,Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量.
(5)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量.
(6)假设实验无损耗,则每片补血剂含铁元素的质量0.07ag(用含a的代数式表示).
分析 方案一:(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸;
(3)酸性溶液或强氧化性溶液应用酸式滴定管;
方案二:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量;
(4)Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(5)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(6)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答 解:方案一:(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原性要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸,故答案为:A;
(3)酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:B;
方案二:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(4)Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量,故步骤②不能省略;
故答案为:不能,Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(6)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量=$\frac{ag×\frac{112}{160}}{10}$=0.07ag;
故答案为:0.07a;
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案| A. | C3H7Cl | B. | C3H6 | C. | CF2Cl2 | D. | C4H6 |
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A. | X的气态氢化物的水溶液显酸性 | |
| B. | X的原子半径小于Y | |
| C. | Z的最外层电子数比Y多 | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
| A. | 羟基的电子式: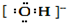 | B. | CH4分子的球棍模型: | ||
| C. | 乙烯的最简式:CH2 | D. | 氟离子的结构示意图: |
| A. | 氨气分子的电子式: | B. | 硫原子结构示意图: | ||
| C. | KCl的电子式: | D. | H2O2的电子式: |
| A. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H2m-nR | |
| B. | 除第ⅡA族族外,其余各族都有非金属元素 | |
| C. | 同一主族相邻的两种元素的原子序数之差可能为16 | |
| D. | 同一短周期元素的原子半径从左到右逐渐减小 |
| A. | NH4CNO与尿素CO(NH2)2 | |
| B. | H2O与D2O | |
| C. | Si(OH)4与H4SiO4 | |
| D. | [Cr(H2O)5Cl]Cl2•H2O与[Cr(H2O)4Cl2]Cl•2H2O |
 将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答: