题目内容
11.将等浓度的一元酸HA溶液与NaOH溶液等体积混合,不能证明HA是弱电解质的方法是( )| A. | 测得0.1mol/L HA的pH>l | |
| B. | 测得NaA溶液的pH>7 | |
| C. | pH=l的HA溶液与盐酸稀释100倍后,盐酸的pH变化大 | |
| D. | 足量锌与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多 |
分析 A.弱电解质不能完全电离;
B.依据盐类水解规律解答;
C.加水稀释能够促进弱电解质电离;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸.
解答 解:A.强酸能够完全电离,0.1mol/L HA强酸的pH=1,而若0.1mol/L HA的pH>l,说明HA不能完全电离,故A为弱酸,故A正确;
B.只有强碱弱酸盐才能水解,NaA溶液的pH>7,说明A-发生水解,则HA为弱酸,故B正确;
C.加水稀释,弱酸电离程度增大,氢离子物质的量增加,PH变化小于2,盐酸中氢离子物质的量不变,故盐酸PH变化为2,故盐酸PH变化大,故C正确;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的Zn反应,醋酸产生的氢气比盐酸多,故D错误;
故选:D.
点评 本题考查弱电解质强弱的判断,熟悉弱电解质电离方式及电离平衡移动影响因素,熟悉盐类水解规律是解题关键,题目难度中等.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
2.下列实验对应的现象及结论均正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
| B | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
| D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
19.下列各元素中,化合价的最高正价数最大的是( )
| A. | F | B. | S | C. | N | D. | Al |
3.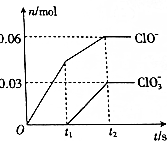 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完成反应(已知反应过程放热),ClO-和ClO3-的物质的量(n)与反应时间(t)的变换关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完成反应(已知反应过程放热),ClO-和ClO3-的物质的量(n)与反应时间(t)的变换关系如图所示.下列说法不正确的是( )
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完成反应(已知反应过程放热),ClO-和ClO3-的物质的量(n)与反应时间(t)的变换关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完成反应(已知反应过程放热),ClO-和ClO3-的物质的量(n)与反应时间(t)的变换关系如图所示.下列说法不正确的是( )| A. | Cl2和苛性钾溶液在不同温度下可能发生不同反应 | |
| B. | t1时刻,c(Cl-):c(ClO-)=5:1 | |
| C. | 原苛性钾溶液中KOH的物质的量为0.3mol | |
| D. | t2时刻,n(还原产物):n(氧化产物)=7:3 |
18.在空气中铝制品比铁制品更不易被锈蚀,原因是( )
| A. | 铝的金属活动性比铁弱 | |
| B. | 铝的密度比铁的密度小 | |
| C. | 铝在空气中易与氧气形成一层致密的氧化膜 | |
| D. | 铝不能与氧气发生反应 |
19.下列实验现象描述不正确的是( )
| A. | 铁丝在氧气中燃烧生成黑色固体物质 | |
| B. | 给水通直流电一段时间,正极和负极的气体体积比为2:1 | |
| C. | 二氧化碳通入紫色石蕊试液,紫色石蕊试液变成红色 | |
| D. | 红磷在空气中燃烧,产生大量白烟 |
