题目内容
|
对2 mol CO2,下列说法中不正确的是 | |
A. |
所含的C、O共6 mol |
B. |
所含的C、O共6NA |
C. |
所含的O共4 mol |
D. |
所含的O2共2NA |
解析:
|
1个CO2分子中含有1个C原子和2个O原子,1 mol CO2分子中含有1 mol C原子和2 mol O原子.1NA与1 mol所含的微粒数相同(6.02×1023),CO2分子中没有O2分子. |

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案|
向1.00 L 0.3 mol/L的NaOH溶液中缓慢通入0.2 mol CO2气体,使其完全反应,对反应后的溶液,下列判断正确的是 | |
A. |
c(OH-)>c(HCO3-) |
B. |
c(HCO3-)>c(CO32-) |
C. |
c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
D. |
c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| |||||||||||||||||||||||||||||||||
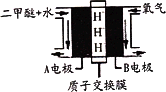



 CO2(g)+2H2O(l)
CO2(g)+2H2O(l)  H2O(l)
H2O(l) 